Síndrome de Birt-Hogg-Dubé - Birt–Hogg–Dubé syndrome
| Síndrome de Birt – Hogg – Dubé | |
|---|---|
 | |
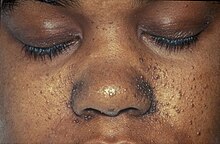
| Os fibrofoliculomas característicos da síndrome de Birt – Hogg – Dubé vistos no rosto de uma pessoa. | |
| Especialidade |
Genética Médica |
A síndrome de Birt – Hogg – Dubé ( BHD ), também a síndrome de Hornstein – Birt – Hogg – Dubé , a síndrome de Hornstein – Knickenberg e fibrofoliculomas com tricodiscomas e acrocórdons é uma doença genética autossômica dominante humana que pode causar suscetibilidade a câncer renal , cistos renais e pulmonares e tumores não cancerosos dos folículos capilares , chamados fibrofoliculomas . Os sintomas observados em cada família são únicos e podem incluir qualquer combinação dos três sintomas. Os fibrofoliculomas são a manifestação mais comum, encontrada na face e na parte superior do tronco em mais de 80% das pessoas com BHD com mais de 40 anos. Os cistos pulmonares são igualmente comuns (84%), mas apenas 24% das pessoas com BHD eventualmente apresentam um colapso pulmão ( pneumotórax espontâneo ). Os tumores renais, cancerosos e benignos, ocorrem em 14–34% das pessoas com BHD; os cânceres renais associados são frequentemente tumores híbridos raros.
Qualquer uma dessas condições que ocorrem em uma família pode indicar um diagnóstico de síndrome de Birt – Hogg – Dubé, embora só seja confirmada por um teste genético para uma mutação no gene FLCN , que codifica a proteína foliculina . Embora sua função não seja totalmente compreendida, parece ser um gene supressor de tumor que restringe o crescimento e a divisão celular. Versões do FLCN foram encontradas em outros animais, incluindo moscas de frutas , pastores alemães , ratos e camundongos . A doença foi descoberta em 1977, mas a conexão com FLCN não foi elucidada até 2002, depois que câncer renal, colapso pulmonar e cistos pulmonares foram todos definitivamente ligados ao BHD.
A síndrome de Birt – Hogg – Dubé pode se manifestar de forma semelhante a outras doenças, que devem ser descartadas ao fazer o diagnóstico. Isso inclui a esclerose tuberosa , que causa lesões cutâneas semelhantes aos fibrofoliculomas, e a doença de Von Hippel-Lindau , que causa câncer renal hereditário. Uma vez diagnosticados, as pessoas com BHD são tratadas preventivamente, com monitoramento de rins e pulmões por meio de imagens médicas . Os fibrofoliculomas podem ser removidos cirurgicamente e o pneumotórax e o câncer renal são tratados de acordo com o padrão normal de atendimento.
sinais e sintomas
Pele
A síndrome de Birt – Hogg – Dubé afeta a pele e aumenta o risco de tumores nos rins e pulmões. A condição é caracterizada por vários tumores não cancerosos em forma de cúpula dos folículos capilares ( fibrofoliculomas ), particularmente na face, pescoço e, mais raramente, na parte superior do tórax. Os fibrofoliculomas são geralmente descritos como tendo uma cor branca opaca ou um tom amarelado e têm uma textura cerosa e lisa. Os tumores são sempre encontrados ao redor do nariz e atrás da orelha externa . Normalmente, eles aparecem pela primeira vez na idade de 20 ou 30 anos e são encontrados em mais de 80% das pessoas com a síndrome acima de 40 anos. Os tumores tornam-se maiores e mais numerosos com o tempo. Os tumores diferem entre os indivíduos; eles podem aparecer mesclados em placas , assemelhar-se a um comedo com um tampão de queratina ou incluir cistos epidermóides . Um grande número de tumores na face pode estar associado à hipervasia ( produção anormalmente elevada de sebo ). A presença de fibrofoliculomas no rosto de uma pessoa pode causar sofrimento psicológico significativo .
Outros tumores podem incluir tricodiscomas (tumores do disco capilar , que podem ser idênticos aos fibrofoliculomas), angiofibromas e fibromas perifoliculares . No entanto, os angiofibromas são mais comuns na esclerose tuberosa. Junto com os tumores, outras doenças de pele são observadas em pessoas com a síndrome de Birt – Hogg-Dubé. Cerca de 40% das pessoas ou famílias com a doença têm pápulas na boca, que podem estar localizadas nas bochechas ( mucosa bucal ), língua, gengivas ou lábios. De cor branca ou mucosa, são discretos, pequenos e macios e consistem em tecido fibroso coberto por epitélio espessado . Os colagenomas da pele também são encontrados em algumas famílias. Muitas pessoas com BHD têm lesões cutâneas que parecem ser acrocórdons (marcas de pele), mas podem ser fibrofoliculomas. Essas lesões geralmente são encontradas na axila , nas pálpebras e nas dobras da pele. Nem todos os indivíduos desenvolvem os tumores faciais; algumas famílias com a mutação que causa BHD desenvolvem apenas tumores renais ou pneumotórax espontâneo.
Rins

Pessoas com mais de 20 anos de idade com BHD têm um risco aumentado de desenvolver tumores renais de crescimento lento ( carcinoma renal cromófobo e oncocitoma renal , respectivamente), cistos renais e possivelmente tumores em outros órgãos e tecidos. Esses tumores costumam ocorrer em ambos os rins e em vários locais em cada rim. O número médio de tumores renais encontrados em uma pessoa com BHD é de 5,3, embora até 28 tumores tenham sido encontrados. Oncocitoma / carcinoma cromófobo híbrido, encontrado em 50% dos casos, é o câncer mais comumente encontrado, seguido por carcinoma renal cromófobo, carcinoma renal de células claras, oncocitoma renal e carcinoma de células renais papilar . Pessoas com mais de 40 anos e homens têm maior probabilidade de desenvolver tumores renais, que são diagnosticados na idade média de 48 anos. O câncer renal associado ao BHD foi diagnosticado em pessoas com apenas 20 anos.
Em geral, as pessoas com essa síndrome correm cerca de sete vezes o risco de câncer de rim em comparação com a população não afetada. As estimativas da incidência entre as pessoas com a doença variam de 14 a 34%. Raramente, está associado ao carcinoma de células renais de células claras e ao carcinoma de células renais papilar . Se se desenvolver em alguém com BHD, o carcinoma de células renais ocorre mais tarde na vida e tem um prognóstico ruim. Embora os tipos de tumores tipicamente associados ao BHD sejam considerados menos agressivos, casos de câncer renal avançado ou metastático foram observados em pessoas com a síndrome. Tanto os tumores benignos quanto os cancerosos podem reduzir a função renal ao longo do tempo, à medida que crescem.
Pulmões
Juntamente com fibrofoliculomas e tumores renais, os indivíduos afectados desenvolvem frequentemente quistos ( vesulas ou bolhas ) no sub pleural pulmão base ou espaço intraparenquimatosa que podem causar ruptura e uma colecção anormal de ar na cavidade torácica ( pneumotórax ), o que poderia resultar no colapso de um pulmão. Os cistos não causam outros sintomas e a função pulmonar geralmente é normal. Mais de 83% das pessoas com BHD têm cistos, mas a síndrome não causa doenças como doença pulmonar obstrutiva crônica progressiva ou insuficiência respiratória generalizada , embora cause enfisema . O pneumotórax espontâneo, às vezes recorrente, ocorre com muito mais frequência e em uma idade mais jovem com BHD do que na população não afetada. Cerca de 24% das pessoas com a doença sofrem pelo menos um pneumotórax espontâneo, 30 vezes a ocorrência em pessoas não afetadas. Embora o pneumotórax causado por BHD frequentemente ocorra na meia-idade, com uma idade média de 38 anos, 17% das pessoas afetadas têm um pneumotórax espontâneo antes de completar 40 anos. Pneumotórax foi observado em pessoas de 7 a 16 anos de idade. Algumas famílias têm uma forma de BHD que afeta apenas os pulmões.
Outros órgãos
Os nódulos da tireoide têm sido associados ao fenótipo Birt – Hogg – Dubé, presente em 65% dos indivíduos e 90% das famílias com a síndrome. No entanto, uma conexão entre BHD e câncer de tireoide não foi comprovada. Foi relatado que outras condições estão associadas, mas podem não ser causadas pela mutação em FLCN ou podem não estar relacionadas de forma alguma. Estes incluem bócio multinodulares , carcinoma medular da tiróide , parótida oncocitoma , polipose colica , nevo do tecido conjuntivo , lipomas , angiolipomas , adenomas paratiróides , Flecked coriorretinopatia , neurothekeoma , meningiomas , angiofibroma da face, trichoblastomas , Mucinose cutânea focal , leiomioma cutânea , cancro da mama, câncer tonsilar , câncer colorretal , sarcoma da perna, câncer de pulmão, melanoma , dermatofibrossarcoma protuberans , carcinoma de células basais , leiomiossarcoma cutâneo e carcinoma de células escamosas .
Fisiopatologia
Genética

Uma associação com o gene da foliculina ( FLCN ) foi relatada pela primeira vez em 2002. Este gene do exon 14 está localizado no braço curto do cromossomo 17 (17p11.2) e possui uma região rica em citosina no exon 11, particularmente suscetível à mutação. A mutação mais comum nessa região é a inserção ou deleção de um resíduo de citosina, encontrada em 53% das famílias afetadas por BHD. Nenhuma diferença significativa foi encontrada nos sintomas experimentados por famílias com uma inserção naquele local em comparação com aqueles que têm uma deleção, mas as mutações em FLCN associadas à síndrome BHD são heterogêneas e muitas vezes são mutações sem sentido ou mutações frameshift que causam truncamento precoce de o produto de proteína no terminal carboxi . Muito raramente, são observadas mutações missense . As mutações são freqüentemente passadas de uma geração para a próxima de forma autossômica dominante, mas podem ocorrer como uma nova mutação em um indivíduo sem história familiar anterior (uma mutação de novo ). Cada filho de um dos pais afetado tem 50% de chance de ter a doença. BHD tem uma penetrância muito alta . Uma correlação entre os diferentes genótipos e fenótipos FLCN não foi descoberta.
Função
A FLCN cria uma proteína, a foliculina, que possui duas isoformas . Ele parece actuar como um supressor de tumor , e é expressa fortemente na pele, distais nefrónios , e pneumócitos tipo I . Também foi encontrado na glândula parótida , cérebro, mama , pâncreas , próstata e ovários . Os supressores de tumor normalmente evitam que as células cresçam e se dividam muito rapidamente ou de forma descontrolada. Mutações no gene FLCN podem interferir na capacidade da foliculina de conter o crescimento e a divisão celular, levando à formação de tumores cancerígenos e não cancerosos. Estudos recentes sugerem que a foliculina cumpre essa função por meio de seu envolvimento com o metabolismo celular , possivelmente por meio da modulação da via mTOR (alvo da rapamicina em mamíferos ) e / ou fosforilação oxidativa na mitocôndria . A foliculina interage com FNIP1 e FNIP2 (proteína que interage com FLCN) para formar um complexo com a proteína quinase ativada por AMP . A participação da foliculina na via mTOR pode explicar a semelhança no fenótipo entre a síndrome BHD, síndrome de Cowden, esclerose tuberosa e síndrome de Peutz-Jeghers .
A maioria das mutações que causam câncer fazem com que a proteína seja truncada no terminal carboxi. A extremidade C-terminal da foliculina demonstrou ser o domínio por meio do qual ela interage com o FNIP1 e, portanto, possivelmente com a via mTOR. FLCN é altamente conservado em vertebrados - é muito semelhante entre muitas espécies de vertebrados. O 508º aminoácido , normalmente a lisina , é afetado por uma mutação missense em algumas pessoas com BHD. A lisina nesta posição encontra-se conservada entre invertebrados e vertebrados ortólogos da foliculina, indicando que é importante para a função da proteína.

Pessoas com BHD nascem com uma cópia mutada do gene FLCN em cada célula. A haploinsuficiência - ter apenas uma cópia funcional do gene FLCN - é suficiente para causar os fibrofoliculomas e cistos pulmonares, embora uma cópia do gene seja suficiente para manter as células renais sob controle. Durante a vida de uma pessoa, mutações aleatórias podem desativar a cópia normal do gene em um subconjunto de células. Quando isso ocorre, o resultado é que essas células não possuem cópias funcionais do gene FLCN , permitindo que as células cresçam sem controle. Essa perda de heterozigosidade é um mecanismo comum no câncer e é frequentemente detectada nos cânceres renais associados ao BHD. Os defeitos genéticos moleculares em tumores renais de pessoas com BHD são diferentes a partir de dois outros tumores renais semelhantes, chromophobe carcinoma de células renais e renal oncocitoma . A tumorigênese associada a BHD difere entre o rim, onde a perda da heterozigose FLCN é responsável pelos cânceres, e a pele, onde a FLCN é fortemente expressa em heterozigotos. Foi descoberto que FLCN é superexpresso no tecido de fibrofoliculoma e tem níveis muito baixos de expressão nos rins afetados. Além disso, a via mTOR mostrou ser ativada no tecido tumoral de humanos e camundongos.
Foi demonstrado que a cistogênese renal e a tumorigênese em BHD são impulsionadas pela ativação constitutiva de TFEB.
Diagnóstico
BHD pode ser sugerido por achados clínicos, mas é definitivamente diagnosticado por testes genéticos moleculares para detectar mutações no gene FLCN . A tríade clínica clássica inclui crescimentos benignos dos folículos pilosos, cistos pulmonares e pneumotórax espontâneo e tumores renais multifocais bilaterais.
Tríade clínica
As manifestações cutâneas de BHD foram originalmente descritas como fibrofoliculomas (crescimentos anormais de um folículo piloso), tricodiscomas (lesões hamartomatosas com um folículo piloso na periferia, frequentemente encontrado na face) e acrocórdons (marcas de pele). As manifestações cutâneas são confirmadas pela histologia . A maioria dos indivíduos (89%) com BHD apresenta múltiplos cistos em ambos os pulmões e 24% tiveram um ou mais episódios de pneumotórax. Os cistos podem ser detectados por tomografia computadorizada de tórax . Os tumores renais podem se manifestar como vários tipos de carcinoma de células renais, mas certos subtipos patológicos (incluindo cromófobo , oncocitoma e tumores híbridos oncocíticos) são mais comumente vistos. Embora a síndrome original tenha sido descoberta com base nos achados cutâneos, os indivíduos com BHD podem manifestar apenas os achados pulmonares e / ou renais, sem lesões cutâneas. Embora esses sinais indiquem BHD, isso só é confirmado com um teste genético para mutações FLCN .
Teste genético
Mutações FLCN são detectadas por sequenciamento em 88% dos probandos com esta síndrome. Isso significa que algumas pessoas com diagnóstico clínico têm mutações que não são detectáveis pela tecnologia atual, ou que mutações em outro gene atualmente desconhecido podem ser responsáveis por uma minoria de casos. Além disso, amplificações e deleções em regiões exônicas também são testadas. O teste genético pode ser útil para confirmar o diagnóstico clínico e fornecer um meio de determinar outros indivíduos em risco em uma família, mesmo que eles ainda não tenham desenvolvido os sintomas de BHD.
Diagnóstico diferencial
O BHD pode ser difícil de diagnosticar apenas com os sintomas, porque cânceres renais hereditários, pneumotórax e tumores cutâneos ocorrem com outras síndromes. Tumores renais multifocais bilaterais hereditários semelhantes aos observados em BHD podem ocorrer com doença de von Hippel-Lindau (carcinoma de células renais de células claras), câncer renal papilar hereditário (carcinoma de células renais papilares) e leiomiomatose hereditária e síndrome do câncer de células renais . Eles são diferenciados com o exame da histologia dos tumores.
Pneumotórax recorrente hereditário ou cistos pulmonares estão associados à síndrome de Marfan , síndrome de Ehlers-Danlos , complexo de esclerose tuberosa , deficiência de alfa1-antitripsina e fibrose cística . Pneumotórax recorrente não hereditário e / ou cistos pulmonares podem ocorrer com histiocitose de células de Langerhans e linfangioleiomiomatose . Essas condições são diferenciadas de BHD por meio do exame da história do paciente e da realização de um exame físico. Em mulheres com suspeita de ter a doença, pode ser necessário descartar endometriose pulmonar ou torácica .
Embora os fibrofoliculomas sejam exclusivos do BHD, eles podem apresentar uma aparência ambígua e devem ser confirmados histologicamente. Outras doenças podem mimetizar as manifestações dermatológicas de BHD, incluindo complexo de esclerose tuberosa, síndrome de Cowden , tricoepiteliomas familiares e neoplasia endócrina múltipla tipo 1 . A esclerose tuberosa deve ser diferenciada porque os dois distúrbios podem se manifestar com angiofibromas na face, embora sejam mais comuns na esclerose tuberosa.
Gestão
As diferentes manifestações de BHD são controladas de maneiras diferentes. Os fibrofoliculomas podem ser removidos cirurgicamente, por meio de curetagem , excisão de barbear , recapeamento de pele ou ablação a laser ; esta não é uma solução permanente, pois os tumores costumam reaparecer. Os sintomas renais e pulmonares são tratados preventivamente: tomografias computadorizadas, ultrassonografias ou ressonâncias magnéticas renais são recomendadas regularmente e os familiares são aconselhados a não fumar. As ressonâncias magnéticas são o método preferido para vigilância dos rins em pessoas com BHD porque não apresentam o mesmo risco de complicações de radiação que as tomografias e são mais sensíveis que os ultrassons. Fumantes com Birt – Hogg – Dubé apresentam sintomas pulmonares mais graves do que os não fumantes. Embora a nefrectomia às vezes seja indicada, os tumores renais em casos de BHD são frequentemente removidos sem a remoção de todo o rim, em uma nefrectomia parcial . Estudos em ratos knockout demonstraram que a administração de rapamicina pode mitigar os efeitos das mutações FLCN nos rins e melhorar o prognóstico do câncer renal devido à interação da foliculina com a via mTOR.
Epidemiologia
O transtorno foi relatado em mais de 100 famílias em todo o mundo, embora algumas fontes citem até 400 famílias, e é herdado em um padrão autossômico dominante. É considerado subdiagnosticado devido à variabilidade em sua expressão. O padrão de mutações e o espectro de sintomas são heterogêneos entre os indivíduos. Fenótipos de pele menos graves são observados em mulheres e pessoas de ambos os sexos que apresentam um início tardio dos sintomas cutâneos.
Registro de paciente
Pacientes, familiares e cuidadores com a Síndrome de Birt-Hogg-Dubé são incentivados a aderir ao NIH Rare Lung Diseases Consortium Contact Registry . Este é um site com privacidade protegida que fornece informações atualizadas para indivíduos interessados nas últimas notícias científicas, ensaios e tratamentos relacionados a doenças pulmonares raras.
História
A síndrome foi bem descrita pela primeira vez em 1977, por três médicos canadenses, Arthur R. Birt, Georgina R. Hogg e William J. Dubé. O primeiro caso de possível BHD na literatura médica foi publicado por Burnier e Rejsek em 1927, que descreveu um caso de fibromas perifoliculares no rosto de uma mulher de 56 anos. Os tricodiscomas foram descritos pela primeira vez em 1974 por HS Zackheim e H. Pinkus, mas não foram associados ao BHD até Birt, Hogg e Dubé. O primeiro caso de BHD com sintomas sistêmicos foi descrito por Hornstein e Knickenberg e encontrado em dois irmãos e seu pai, todos com pólipos no cólon e os fibrofoliculomas característicos. Embora os irmãos não apresentassem sintomas renais ou pulmonares, o pai deles tinha cistos nos pulmões e nos rins. A síndrome de Hornstein-Knickenberg é um nome agora obsoleto para os fibrofoliculomas herdados inerentes ao BHD.
Birt, Hogg e Dubé examinaram uma família com câncer hereditário de tireoide e descobriram que muitos dos membros tinham fibrofoliculomas, tricodiscomas e acrocórdons, que foram definidos como os sintomas clássicos da doença de mesmo nome. O primeiro caso de pneumotórax espontâneo associado a BHD foi descoberto em 1986; o primeiro caso de câncer renal ocorreu em 1993, e a presença de cistos pulmonares em pessoas com BHD foi confirmada em 1999. Antigamente, pensava-se que as pessoas com BHD apresentavam maior risco de pólipos colorretais e neoplasias , mas isso foi refutado. A Fundação BHD apóia pesquisas sobre a síndrome e realiza simpósios regulares sobre BHD e doenças relacionadas para pesquisadores, médicos e familiares.
Outros animais
Genes relacionados a FLCN e doenças semelhantes a BHD foram encontrados em cães, moscas de frutas, ratos e camundongos. Em cães pastor alemão, as mutações missense no ortólogo canino de FLCN causam um fenótipo semelhante ao BHD humano - cânceres renais (neste caso, cistadenocarcinoma renal multifocal ) e tumores de pele ( dermatofibrose nodular ). Eles tinham um padrão de tumorigênese semelhante ao BHD humano em que as lesões cutâneas eram heterozigotas para a mutação FLCN e os tumores renais eram provavelmente causados pela perda de heterozigosidade. Pastoras alemãs com uma mutação FLCN também são propensas a leiomiomas uterinos .
Um homólogo de FLCN chamado DBHD foi descoberto na mosca da fruta comum, Drosophila melanogaster . A diminuição da expressão do DBHD resulta na perda de células-tronco da linha germinativa masculina (GSC), o que sugere que o DBHD é necessário para a manutenção do GSC masculino no testículo da mosca. Além disso, DBHD regula a manutenção de GSC a jusante ou em paralelo das vias de transdução de sinal JAK / STAT e Dpp, o que sugere que BHD regula a tumorigênese controlando células-tronco em humanos {Singh et al. 2006}
Uma linha de ratos com câncer renal hereditário foi desenvolvida por pesquisadores japoneses. Eles têm uma mutação no homólogo FLCN que produz uma proteína truncada, embora não desenvolvam os sintomas cutâneos ou pulmonares vistos em humanos. Os heterozigotos têm anormalidades renais observadas muito cedo na vida que se desenvolvem em tumores de células claras e híbridos, encurtando significativamente o tempo de vida dos animais; eles também são propensos à hiperplasia de células claras das glândulas endometrial e salivar , bem como à rabdomiólise . Os homozigotos não sobrevivem ao nascimento. Quando um gene FLCN de tipo selvagem foi adicionado, o fenótipo foi resgatado.
Camundongos knockout foram criados para uma mutação de BHD que causa câncer de rim; heterozigotos desenvolvem cistos renais e tumores que levam à insuficiência renal dentro de três semanas de nascimento. Nestes camundongos, a via mTOR foi inadequadamente ativada, indicando que o homólogo de camundongo de FLCN desempenha um papel regulador nesta via. A rapamicina resgatou parcialmente o fenótipo regulando o mTOR. Os homozigotos morrem no útero .
Referências
Citações
Bibliografia
- Ayo, Dereje S .; Aughenbaugh, GL; Yi, ES; Mão, JL; Ryu, JH (2007), "Cystic Lung Disease in Birt-Hogg-Dubé Syndrome", Chest , 132 (2): 679–84, doi : 10.1378 / chest.07-0042 , PMID 17505035
- Birt, AR; Hogg, GR; Dubé, WJ (1977), "Hereditary multiple fibrofolliculomas with trichodiscomas and acrochordons", Archives of Dermatology , 113 (12): 1674–7, doi : 10.1001 / archderm.113.12.1674 , PMID 596896
- Fundação BHD , 2013 , recuperado em 17 de julho de 2013
- Chan-Smutko, Gayun (2012), "Genetic Testing by Cancer Site", The Cancer Journal , 18 (4): 343–9, doi : 10.1097 / PPO.0b013e31826246ac , PMID 22846736
- Coleman, Jonathan A; Russo, Paul (2009), "Hereditary and familial kidney cancer", Current Opinion in Urology , 19 (5): 478–85, doi : 10.1097 / MOU.0b013e32832f0d40 , PMID 19584731
- Devine, Megan Stuebner; Garcia, Christine Kim (2012), "Genetic Interstitial Lung Disease", Clinics in Chest Medicine , 33 (1): 95-110, doi : 10.1016 / j.ccm.2011.11.001 , PMC 3292740 , PMID 22365249
- Furuya, M .; Nakatani, Y. (2012), "Birt-Hogg-Dube syndrome: Clinicopathological features of the lung", Journal of Clinical Pathology , 66 (3): 178–86, doi : 10.1136 / jclinpath-2012-201200 , PMC 3595143 , PMID 23223565
- "Síndrome de Birt-Hogg-Dubé" , Genetics Home Reference , US National Library of Medicine, janeiro de 2013 , recuperado em 13 de julho de 2013
- "Birt-Hogg-Dubé syndrome: Educational resources" , Genetics Home Reference , NIH, 22 de julho de 2013, arquivado do original em 15 de março de 2016 , recuperado em 25 de julho de 2013
- Grant, LA; Babar, J .; Griffin, N. (2009), "Cistos, cavidades e faveolamento em doenças multissistêmicas: diagnóstico diferencial e resultados em TC de seção fina", Radiologia Clínica , 64 (4): 439-48, doi : 10.1016 / j.crad. 2008.09.015 , PMID 19264190
- James, William D .; Berger, Timothy; Elston, Dirk (2011), Andrew's Diseases of the Skin: Clinical Dermatology (11ª ed.), Elsevier Health Sciences, ISBN 978-1-4377-3619-9
- Kniffin, Cassandra L. (22 de agosto de 2012), "Birt-Hogg-Dube syndrome, BHD" , Online Mendelian Inheritance in Man , Johns Hopkins University, arquivado do original em 10 de março de 2017 , recuperado em 13 de julho de 2013
- Liu, Wei; Chen, Zhi; Ma, Yansen; Wu, Xiaochun; Jin, Yaping; Hou, Steven (2013), White-Cooper, Helen (ed.), "Genetic Characterization of the Drosophila Birt-Hogg-Dubé Syndrome Gene", PLOS ONE , 8 (6): e65869, Bibcode : 2013PLoSO ... 865869L , doi : 10.1371 / journal.pone.0065869 , PMC 3684598 , PMID 23799055
- Maher, Eamonn R. (2011), "Genetics of Familial Renal Cancers", Nephron Experimental Nephrology , 118 (1): e21-6, doi : 10.1159 / 000320892 , PMID 21071978 , S2CID 23464317
- Menko, Fred H; Van Steensel, Maurice AM; Giraud, Sophie; Friis-Hansen, Lennart; Richard, Stéphane; Ungari, Silvana; Nordenskjöld, Magnus; Hansen, Thomas vO; Solly, John; Maher, Eamonn R; European Bhd, Consortium (2009), "Birt-Hogg-Dubé syndrome: Diagnosis and management", The Lancet Oncology , 10 (12): 1199–206, doi : 10.1016 / S1470-2045 (09) 70188-3 , PMID 19959076
- BHD Foundation , National Organization for Rare Disorders, 2013, arquivado do original em 3 de novembro de 2013 , recuperado em 25 de julho de 2013
- Nickerson, Michael L .; Warren, Michelle B .; Toro, Jorge R .; Matrosova, Vera; Glenn, Gladys; Turner, Maria L .; Duray, Paul; Merino, Maria; Choyke, Peter; et al. (2002), "Mutações em um novo gene levam a tumores renais, defeitos da parede pulmonar e tumores benignos do folículo piloso em pacientes com a síndrome de Birt-Hogg-Dubé", Cancer Cell , 2 (2): 157-64, doi : 10.1016 / S1535-6108 (02) 00104-6 , PMID 12204536
- Palmirotta, Raffaele; Savonarola, Annalisa; Ludovici, Giorgia; Donati, Pietro; Cavaliere, Francesco; De Marchis, Maria Laura; Ferroni, Patrizia; Guadagni, Fiorella (março de 2010), "Associação entre a síndrome de Birt Hogg Dubé e a predisposição ao câncer" , Anticancer Res. , 30 (3): 751–7, PMID 20392993
- Reese, Erin; Sluzevich, Jason; Kluijt, Irma; Teertstra, H. Jelle; De Jong, Daphne; Horenblas, Simon; Ryu, Jay (5 de outubro de 2009), "Birt-Hogg-Dubé Syndrome" , em Riegert-Johnson, Douglas L; Boardman, Lisa A; Hefferon, Timothy; Roberts, Maegan (eds.), Cancer Syndromes , Bethesda, MD: National Center for Biotechnology Information, PMID 21249760
- Riegert-Johnson, DL, "Birt-Hogg-Dube" , Familial Cancer Syndromes , NCBI , recuperado em 21 de julho de 2009
- Sudarshan, Sunil; Karam, Jose A .; Brugarolas, James; Thompson, R. Houston; Uzzo, Robert; Rini, Brian; Margulis, Vitaly; Patard, Jean-Jacques; Escudier, Bernard; Linehan, W. Marston (2013), "Metabolism of Kidney Cancer: From the Lab to Clinical Practice", European Urology , 63 (2): 244–51, doi : 10.1016 / j.eururo.2012.09.054 , PMC 3709870 , PMID 23063455
- Toro, Jorge R. (9 de setembro de 2008), "Birt-Hogg-Dubé Syndrome" , em Pagon, Roberta A; Adam, Margaret P; Bird, Thomas D; Dolan, Cynthia R; Fong, Chin-To; Smith, Richard JH; Stephens, Karen (eds.), GeneReviews , University of Washington, PMID 20301695
- Toro, JR; Wei, MH; Glenn, GM; Weinreich, M; Touré, O; Vocke, C; Turner, M; Choyke, P; Merino, MJ; et al. (2008), "Mutações BHD, investigações clínicas e genéticas moleculares da síndrome de Birt-Hogg-Dube: Uma nova série de 50 famílias e uma revisão de relatórios publicados", Journal of Medical Genetics , 45 (6): 321-31, doi : 10.1136 / jmg.2007.054304 , PMC 2564862 , PMID 18234728
- Verine, Jérôme; Pluvinage, Amélie; Bousquet, Guilhem; Lehmann-Che, Jacqueline; De Bazelaire, Cédric; Soufir, Nadem; Mongiat-Artus, Pierre (2010), "Hereditary Renal Cancer Syndromes: An Update of a Systematic Review", European Urology , 58 (5): 701–10, doi : 10.1016 / j.eururo.2010.08.031 , PMID 20817385
links externos
| Classificação | |
|---|---|
| Fontes externas |


