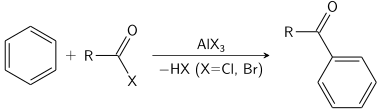Substituição eletrofílica aromática - Electrophilic aromatic substitution
A substituição eletrofílica aromática é uma reação orgânica na qual um átomo ligado a um sistema aromático (geralmente hidrogênio) é substituído por um eletrófilo . Algumas das substituições aromáticas electrofílicos mais importantes são a nitração aromática , halogenação aromática , sulfonação aromático , e alquilação e acilação de reacção de Friedel-Crafts .
Reações ilustrativas
O exemplo mais amplamente praticado dessa reação é a etilação do benzeno.
Aproximadamente 24.700.000 toneladas foram produzidas em 1999. (Após a desidrogenação e polimerização, o poliestireno plástico commodity é produzido.) Nesse processo, os ácidos são usados como catalisadores para gerar o carbocátion incipiente. Muitas outras reações eletrofílicas do benzeno são conduzidas, embora em uma escala muito menor; eles são rotas valiosas para intermediários-chave. A nitração do benzeno é obtida pela ação do íon nitrônio como eletrófilo. A sulfonação com ácido sulfúrico fumante dá ácido benzenossulfônico . A halogenação aromática com bromo , cloro ou iodo dá os halogenetos de arila correspondentes. Esta reação é tipicamente catalisada pelo trihaleto de ferro ou alumínio correspondente.
A reação de Friedel-Crafts pode ser realizada como uma acilação ou como uma alquilação . Freqüentemente, o tricloreto de alumínio é usado, mas quase qualquer ácido de Lewis forte pode ser aplicado. Para a reação de acilação, é necessária uma quantidade estequiométrica de tricloreto de alumínio.
Mecanismo de reação
O mecanismo geral de reação, denotado pelo símbolo mecanístico de Hughes – Ingold S E Ar , começa com o anel aromático atacando o eletrófilo E + . Essa etapa leva à formação de um cátion ciclohexadienil com carga positiva e deslocalizada , também conhecido como íon arênio, intermediário de Wheland ou complexo σ de areno. Muitos exemplos deste carbocátion foram caracterizados, mas em condições normais de operação, essas espécies altamente ácidas doarão o próton ligado ao carbono sp 3 para o solvente (ou qualquer outra base fraca) para restabelecer a aromaticidade. O resultado líquido é a substituição de H por E no anel arila. Ocasionalmente, outros eletrofugadores (grupos que podem sair sem seu par de elétrons ) ao lado de H + partirão para restabelecer a aromaticidade; essas espécies incluem grupos silil (como SiR 3 + ), o grupo carboxi (como CO 2 + H + ), o grupo iodo (como I + ) e grupos alquil terciários como t- butil (como R + ). A capacidade de saída desses tipos de substituintes é algumas vezes explorada sinteticamente, particularmente no caso de substituição do silila por outro grupo funcional ( ataque ipso ). No entanto, a perda de grupos como iodo ou alquil é mais frequentemente uma reação secundária indesejada.
Efeito dos grupos substituintes
Tanto a regiosseletividade - os diversos padrões de substituição de areno - e a velocidade de uma substituição aromática eletrofílica são afetadas pelos substituintes já ligados ao anel de benzeno. Em termos de regiosseletividade, alguns grupos promovem a substituição nas posições orto ou para, enquanto outros grupos favorecem a substituição na posição meta. Esses grupos são chamados de direcionamento orto-para ou metodirecionamento , respectivamente. Além disso, alguns grupos aumentarão a taxa de reação ( ativação ), enquanto outros irão diminuir a taxa ( desativação ). Enquanto os padrões de regiosseletividade podem ser explicados com estruturas de ressonância , a influência na cinética pode ser explicada tanto pelas estruturas de ressonância quanto pelo efeito indutivo .
Taxa de reação
Os substituintes geralmente podem ser divididos em duas classes em relação à substituição eletrofílica: ativação e desativação em direção ao anel aromático. Substituintes de ativação ou grupos de ativação estabilizam o intermediário catiônico formado durante a substituição, doando elétrons para o sistema de anel, por efeito indutivo ou efeitos de ressonância . Exemplos de anéis aromáticos ativados são tolueno , anilina e fenol .
A densidade extra de elétrons entregue no anel pelo substituinte não é distribuída uniformemente por todo o anel, mas está concentrada nos átomos 2, 4 e 6, de modo que os substituintes ativadores também são diretores orto / para (ver abaixo).
Por outro lado, a desativação de substituintes desestabiliza o cátion intermediário e, assim, diminui a taxa de reação por efeitos indutivos ou de ressonância. Eles fazem isso retirando a densidade do elétron do anel aromático. A desativação do sistema aromático significa que geralmente condições mais severas são necessárias para conduzir a reação até o fim. Um exemplo disso é a nitração do tolueno durante a produção do trinitrotolueno (TNT). Enquanto a primeira nitração, no anel de tolueno ativado, pode ser feita à temperatura ambiente e com ácido diluído, a segunda, no anel de nitrotolueno desativado, já necessita de aquecimento prolongado e ácido mais concentrado, e a terceira, em desativação muito forte dinitrotolueno, deve ser feito em ácido sulfúrico concentrado fervente . Os grupos que estão se retirando de elétrons por ressonância diminuem a densidade do elétron especialmente nas posições 2, 4 e 6, deixando as posições 3 e 5 como aquelas com reatividade comparativamente mais alta, de modo que esses tipos de grupos são meta-diretores (veja abaixo). Halogênios são eletronegativos, então eles são desativados por indução, mas eles têm pares solitários, então eles são doadores de ressonância e, portanto, diretores orto / para.
Ortho / para diretores
Grupos com pares de elétrons não compartilhados , como o grupo amino da anilina , são fortemente ativados e orto / para- direcionados por ressonância. Esses grupos de ativação doam esses elétrons não compartilhados para o sistema pi , criando uma carga negativa nas posições orto e para. Essas posições são, portanto, as mais reativas para um eletrófilo pobre em elétrons. A maior densidade de elétrons está localizada nas posições orto e para, embora essa reatividade aumentada possa ser compensada por impedimento estérico entre o substituinte e o eletrófilo. O resultado final da substituição aromática eletrofílica pode, portanto, ser difícil de prever, e geralmente só é estabelecido fazendo a reação e determinando a razão de substituição orto versus para.
Além da natureza nucleofílica aumentada do anel original, quando o eletrófilo ataca as posições orto e para da anilina, o átomo de nitrogênio pode doar densidade de elétrons ao sistema pi (formando um íon imínio ), dando quatro estruturas de ressonância (em oposição a três na reação básica). Isso aumenta substancialmente a estabilidade do intermediário catiônico.
Quando o eletrófilo ataca a posição meta , o átomo de nitrogênio não pode doar densidade de elétrons ao sistema pi , dando apenas três contribuintes de ressonância. Esse raciocínio é consistente com baixos rendimentos de produto meta- substituído.
Outros substituintes, tais como os de alquilo e arilo substituintes , também podem doar electrões densidade para o pi sistema; no entanto, como não têm um par de elétrons não compartilhado disponível, sua capacidade de fazer isso é bastante limitada. Assim, eles ativam apenas fracamente o anel e não desfavorecem fortemente a posição meta .
A orto metalação dirigida é um tipo especial de EAS com orto-diretores especiais .
Meta diretores
Grupos não halógenos com átomos que são mais eletronegativos do que carbono, como um grupo de ácido carboxílico (-CO 2 H), retiram densidade eletrônica substancial do sistema pi . Esses grupos são grupos fortemente desativadores . Além disso, como o carbono substituído já é pobre em elétrons, qualquer estrutura que tenha um contribuidor de ressonância em que haja uma carga positiva no carbono que carrega o grupo de retirada de elétrons (isto é, ataque orto ou para ) é menos estável do que as outras. Portanto, esses grupos de retirada de elétrons são meta- direcionadores porque esta é a posição que não apresenta tanta desestabilização.
A reação também é muito mais lenta (uma taxa de reação relativa de 6 × 10 -8 em comparação com o benzeno) porque o anel é menos nucleofílico.
Reação na piridina
Em comparação com o benzeno, a taxa de substituição eletrofílica na piridina é muito mais lenta, devido à maior eletronegatividade do átomo de nitrogênio. Além disso, o nitrogênio na piridina obtém facilmente uma carga positiva por protonação (de nitração ou sulfonação ) ou ácidos de Lewis (como AlCl 3 ) usados para catalisar a reação. Isso torna a reação ainda mais lenta por ter cargas formais adjacentes em carbono e nitrogênio ou 2 cargas formais em um átomo localizado. Fazer uma substituição eletrofílica diretamente na piridina é quase impossível.
Para fazer a reação, elas podem ser feitas por 2 reações possíveis, que são ambas indiretas.
Uma maneira possível de fazer uma substituição na piridina é a substituição nucleofílica aromática. Mesmo sem catalisadores, o átomo de nitrogênio, sendo eletronegativo, pode conter a carga negativa por si mesmo. Outra forma é fazer uma oxidação antes da substituição eletrofílica. Isso produz o N- óxido de piridina , que, devido ao átomo de oxigênio negativo, torna a reação mais rápida do que a piridina e até mesmo o benzeno. O óxido pode então ser reduzido à piridina substituída.
Ataque ipso
A ligação de um grupo de entrada a uma posição em um composto aromático que já carrega um grupo substituinte (diferente de hidrogênio). O grupo de entrada pode deslocar esse grupo substituinte, mas também pode ser expulso ou migrar para outra posição em uma etapa subsequente. O termo ' substituição ipso ' não é usado, pois é sinônimo de substituição. Um exemplo clássico é a reação do ácido salicílico com uma mistura de ácido nítrico e sulfúrico para formar ácido pícrico . A nitração da posição 2 envolve a perda de CO 2 como grupo de saída. A dessulfonação em que um grupo sulfonil é substituído por um próton é um exemplo comum. Veja também rearranjo de Hayashi . Nos aromáticos substituídos por silício, o silício reage por substituição ipso .
Heterociclos de cinco membros
Em comparação com o benzeno, furanos , tiofenos e pirróis são mais suscetíveis ao ataque eletrofílico. Todos esses compostos contêm um átomo com um par não compartilhado de elétrons ( oxigênio , enxofre ou nitrogênio ) como um membro do anel aromático, que estabiliza substancialmente o intermediário catiônico. Exemplos de substituições eletrofílicas do pirrol são a reação de Pictet-Spengler e a reação de Bischler-Napieralski .
Substituição eletrofílica aromática assimétrica
As substituições eletrofílicas aromáticas com eletrófilos de carbono pró - quirais foram adaptadas para a síntese assimétrica pela mudança para catalisadores de ácido de Lewis quirais , especialmente em reações do tipo Friedel-Crafts . Um exemplo inicial diz respeito à adição de cloral a fenóis catalisados por cloreto de alumínio modificado com (-) - mentol . Um composto de glioxilato foi adicionado a N, N-dimetilanilina com um ligante bisoxazolina quiral - sistema de catalisador triflato de cobre (II) também em uma hidroxialquilação de Friedel-Crafts :
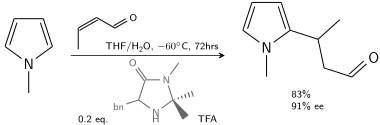
Em outra alquilação, o N-metilpirrol reage com o crotonaldeído catalisado por ácido trifluoroacético modificado com uma imidazolidinona quiral :
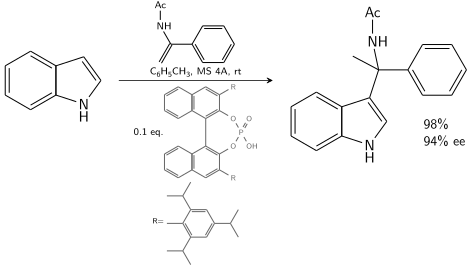
O indol reage com uma enamida catalisada por um ácido fosfórico derivado de BINOL quiral :
Na presença de 10–20% de catalisador quiral, 80–90% ee é alcançável.
Outras reações
- Outras reações que seguem um padrão de substituição aromática eletrofílica são um grupo de reações de formilação aromática, incluindo a reação de Vilsmeier-Haack , a reação de Gattermann Koch e a reação de Reimer-Tiemann .
- Outros eletrófilos são sais de diazônio aromáticos em acoplamentos de diazônio , dióxido de carbono na reação de Kolbe-Schmitt e grupos carbonila ativados na condensação de Pechmann , íon hidroxicarbênio na clorometilação de Blanc por meio de um intermediário (hidroximetil) areno (álcool benzílico), cátion cloro (ClO 3 + ) para perclorilação eletrofílica .
- Na reação de Lehmstedt – Tanasescu de várias etapas , um dos eletrófilos é um intermediário N-nitroso.
- Na reação de Tscherniac – Einhorn (em homenagem a Joseph Tscherniac e Alfred Einhorn ), o eletrófilo é um N-metanol derivado de uma amida