Interações glicano-proteína - Glycan-protein interactions
As interações glicano-proteína representam uma classe de interações biomoleculares que ocorrem entre glicanos livres ou ligados a proteínas e seus parceiros de ligação cognatos. Interações intramoleculares glicano-proteína (proteína-glicano) ocorrem entre glicanos e proteínas às quais eles estão covalentemente ligados. Junto com as interações proteína-proteína , eles formam uma base mecanística para muitos processos celulares essenciais , especialmente para interações célula-célula e interações célula-hospedeiro. Por exemplo, o SARS-CoV-2 , o agente causador de COVID-19 , emprega sua proteína spike (S) amplamente glicosilada para se ligar ao receptor ACE2 , permitindo que ele entre nas células hospedeiras. A proteína spike é uma estrutura trimérica , com cada subunidade contendo 22 locais de N-glicosilação, tornando-a um alvo atraente para a pesquisa de vacinas .
Os glicanos, um nome genérico para monossacarídeos e oligossacarídeos , representam uma das principais modificações pós-tradução das proteínas, contribuindo para a enorme complexidade biológica da vida. Na verdade, três hexoses diferentes poderiam teoricamente produzir de 1056 a 27.648 trissacarídeos únicos em contraste com apenas 6 peptídeos ou oligonucleotídeos formados a partir de 3 aminoácidos ou 3 nucleotídeos, respectivamente. Em contraste com a biossíntese de proteínas guiada por modelos , a "linguagem" da glicosilação ainda é desconhecida, tornando a glicobiologia um tópico quente da pesquisa atual, dada sua prevalência em organismos vivos.
O estudo das interações glicano-proteína fornece uma visão sobre os mecanismos de sinalização celular e permite criar melhores ferramentas de diagnóstico para muitas doenças, incluindo o câncer . Na verdade, não existem tipos conhecidos de câncer que não envolvam padrões erráticos de glicosilação de proteínas .
Termodinâmica da Ligação
A ligação das proteínas de ligação ao glicano (GBPs) aos glicanos pode ser modelada com equilíbrio simples . Denotando glicanos como e proteínas como :
Com uma constante de equilíbrio associada de
Que é reorganizado para fornecer a constante de dissociação de acordo com as convenções bioquímicas:
Dado que muitos GBPs apresentam multivalência, este modelo pode ser expandido para considerar vários equilíbrios:
Denotando equilíbrio cumulativo de ligação com ligantes como
Com a constante de equilíbrio correspondente:
E escrever balanço de material para proteína ( denota a concentração total de proteína):
Expressando os termos por meio de uma constante de equilíbrio, um resultado final é encontrado:
A concentração de proteína livre é, assim:
Se , ou seja, houver apenas um domínio de receptor de carboidrato, a equação se reduz a
Com o aumento da concentração de proteína livre diminui; portanto, a aparente diminui também.
Ligação com anéis aromáticos
A intuição química sugere que os locais de ligação do glicano podem ser enriquecidos em resíduos de aminoácidos polares que formam interações não covalentes , como ligações de hidrogênio , com carboidratos polares . De fato, uma análise estatística dos bolsões de ligação de carboidratos mostra que os resíduos de ácido aspártico e asparagina estão presentes duas vezes mais do que seria previsto ao acaso. Surpreendentemente, há uma preferência ainda mais forte por aminoácidos aromáticos : o triptofano tem um aumento de 9 vezes na prevalência, a tirosina tem um aumento de 3 vezes e a histidina um aumento de 2 vezes. Foi demonstrado que a força subjacente é a interação entre o sistema aromático e o em carboidrato, como mostrado na Figura 1 . A interação é identificada se o °, a distância (distância de a ) for menor que 4,5Å.
Efeitos da estereoquímica
Essa interação depende fortemente da estereoquímica da molécula de carboidrato . Por exemplo, considere as faces superior ( ) e inferior ( ) de -D-Glucose e -D-Galactose . Foi demonstrado que uma única mudança na estereoquímica no carbono C4 muda a preferência por resíduos aromáticos do lado (preferência 2,7 vezes para a glicose) para o lado (preferência 14 vezes para a galactose).
Efeitos da eletrônica
A comparação dos potenciais eletrostáticos de superfície (ESPs) de anéis aromáticos em triptofano , tirosina , fenilalanina e histidina sugere que os efeitos eletrônicos também desempenham um papel na ligação aos glicanos (ver Figura 2 ). Depois de normalizar as densidades de elétrons para a área de superfície, o triptofano ainda permanece o aceitador de interações mais rico em elétrons , sugerindo uma possível razão para sua prevalência de 9 vezes em bolsas de ligação de carboidratos. No geral, os mapas de potencial eletrostático seguem a tendência de prevalência de .
Parceiros de ligação de carboidratos
Existem muitas proteínas capazes de se ligar a glicanos, incluindo lectinas , anticorpos , adesinas microbianas , aglutininas virais , etc.
Lectinas
Lectinas é um nome genérico para proteínas com domínios de reconhecimento de carboidratos (CRD). Embora tenha se tornado quase sinônimo de proteínas de ligação ao glicano, não inclui anticorpos que também pertencem à classe.
Lectinas encontradas em plantas e células de fungos têm sido amplamente utilizadas em pesquisas como uma ferramenta para detectar, purificar e analisar glicanos. No entanto, lectinas úteis geralmente têm especificidades abaixo do ideal . Por exemplo, Ulex europaeus aglutinina-1 (UEA-1), uma lectina extraída de planta capaz de se ligar ao antígeno de sangue humano tipo O , também pode se ligar a glicanos não relacionados, como 2'-fucosilactose, GalNAcα1-4 (Fucα1-2) Galβ1-4GlcNAc e antígeno Lewis-Y .
Anticorpos
Embora os anticorpos exibam afinidades nanomolares com relação aos antígenos proteicos, a especificidade contra os glicanos é muito limitada. Na verdade, os anticorpos disponíveis podem ligar apenas <4% dos 7.000 antígenos de glicano de mamíferos; além disso, a maioria desses anticorpos tem baixa afinidade e exibe reatividade cruzada.
Lambodies
Em contraste com mandibulados vertebrados cuja imunidade baseia-se em diversas variáveis, e segmentos, juntando genes (VDJs) de imunoglobulinas , os jawless invertebrados , tais como a lampreia e Myxinidae , criar uma diversidade de receptores por somática ADN rearranjo de leucina rico em repetição (LRR) módulos que são incorporados em genes * vlr * (receptores de leucócitos variáveis). Esses LRR formam estruturas 3D que se assemelham a solenóides curvos que se ligam seletivamente a glicanos específicos.
Um estudo da Universidade de Maryland, demonstrou que os anticorpos (lampreia) lambodies poderia se ligam selectivamente ao tumor -associated antigénios de hidratos de carbono (tais como Tn e TF ) em afinidades nanomolares. O antígeno T-nouvelle (Tn) e o TF estão presentes nas proteínas em até 90% das diferentes células cancerosas após a modificação pós-tradução , enquanto nas células saudáveis esses antígenos são muito mais complexos. Uma seleção de lambodies que poderiam se ligar a aGPA , uma glicoproteína de membrana eritrocitária humana que é coberta com 16 frações TF , por meio de classificação de células ativadas magneticamente (MACS) e classificação de células ativadas por fluorescência (FACS) produziu um lambody rico em leucina VLRB. aGPA.23 . Esta lambodia corou seletivamente (sobre amostras saudáveis) células de 14 tipos diferentes de adenocarcinomas : bexiga , esôfago , ovário , língua , bochecha, colo do útero , fígado , nariz, nasofaringe , omento maior, cólon , mama , laringe e pulmão . Além disso, os pacientes cujos tecidos foram corados positivamente com VLRB.aGPA.23 tiveram uma taxa de sobrevivência significativamente menor.
Uma análise mais detalhada da estrutura cristalina de VLRB.aGPA.23 revela um resíduo de triptofano na posição 187, logo acima da bolsa de ligação de carboidratos.
Multivalência na estrutura
Muitas proteínas de ligação de glicano (GBPs) são oligoméricas e normalmente contêm vários locais para ligação de glicano (também chamados de domínios de reconhecimento de carboidratos). A capacidade de formar interações multivalentes de proteína- ligante aumenta significativamente a força de ligação: enquanto os valores para interações individuais de CRD-glicano podem estar na faixa de mM, a afinidade geral de GBP para glicanos pode atingir faixas nanomolares ou mesmo picomolares . A força geral das interações é descrita como avidez (em contraste com uma afinidade que descreve o equilíbrio único). Às vezes, a avidez também é chamada de aparente para enfatizar a natureza de não equilíbrio da interação.
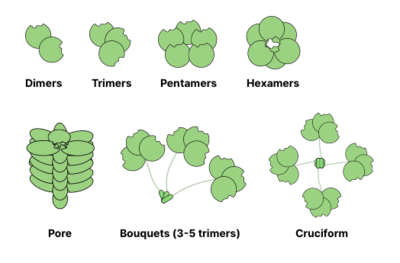
Estruturas de oligomerização comuns de lectinas são mostradas abaixo. Por exemplo, as galectinas são geralmente observadas como dímeros, enquanto as intelectinas formam trímeros e as pentraxinas se agrupam em pentâmeros. Estruturas maiores, como proteínas Reg hexaméricas , podem se reunir em poros que penetram na membrana. As colectinas podem formar complexos ainda mais bizarros: buquês de trímeros ou mesmo estruturas semelhantes a cruciformes (por exemplo, em SP-D ).
Pesquisa atual
Dada a importância das interações glicano-proteína, há uma pesquisa em andamento dedicada a a) criação de novas ferramentas para detectar interações glicano-proteína eb) usar essas ferramentas para decifrar o chamado código do açúcar.
Glycan Arrays
Uma das ferramentas mais amplamente utilizadas para sondar as interações glicano-proteína são os arranjos de glicano . Uma matriz de glicano geralmente é uma lâmina de vidro ativada por NHS ou epóxi nas quais vários glicanos foram impressos por meio de impressão robótica. Essas matrizes disponíveis comercialmente podem conter até 600 glicanos diferentes, cuja especificidade foi amplamente estudada.
As interações glicano-proteína podem ser detectadas testando proteínas de interesse (ou bibliotecas daquelas) que possuem marcadores fluorescentes . A estrutura da proteína de ligação ao glicano pode ser decifrada por vários métodos analíticos baseados em espectrometria de massa , incluindo MALDI-MS , LC-MS , tandem MS-MS e / ou 2D NMR .
Pesquisa conduzida por bioinformática
Métodos computacionais têm sido aplicados para pesquisar parâmetros (por exemplo, propensão a resíduos, hidrofobicidade, planaridade) que podem distinguir proteínas de ligação ao glicano de outras manchas de superfície. Por exemplo, um modelo treinado em 19 estruturas de ligação a carboidratos não homólogas foi capaz de prever domínios de ligação a carboidratos (CRDs) com uma precisão de 65% para estruturas não enzimáticas e 87% para enzimáticas. Outros estudos empregaram cálculos de energias de Van der Waals de interações proteína-sonda e propensões de aminoácidos para identificar CRDs com especificidade de 98% e sensibilidade de 73% . Métodos mais recentes podem prever CRDs mesmo a partir de sequências de proteínas , comparando a sequência com aquelas cujas estruturas já são conhecidas.
Código de açúcar
Em contraste com estudos de proteínas, onde uma estrutura de proteína primária é inequivocamente definida pela sequência de nucleotídeos (o código genético ), a glicobiologia ainda não consegue explicar como uma certa "mensagem" é codificada usando carboidratos ou como ela é "lida" e "traduzida "por outras entidades biológicas.
Um esforço interdisciplinar, combinando química, biologia e bioquímica, estuda as interações glicano-proteína para ver como diferentes sequências de carboidratos iniciam diferentes respostas celulares.





![{\ displaystyle K_ {a} = {\ frac {[PG]} {[P] [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/38c58e2be67844c3537babb4f86e1ca38a60d94b)

![{\ displaystyle K_ {d} = {\ frac {[P] [G]} {[PG]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/72976d7d2ea5a25b59b79f62a8f778c4c3bac42b)






![{\ displaystyle \ beta _ {i} = {\ frac {[PG_ {i}]} {[P] [G] ^ {i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9153a83607a00bc4eb96cdf6928a07a2024f1bdd)

![{\ displaystyle c_ {P} = [P] + [PG] + \ dots + [PG_ {n}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e1cabed41f72e76cf6c1a5e2886153b4bbdfebdc)
![{\ displaystyle c_ {P} = [P] (1+ \ beta _ {1} [G] + \ dots + \ beta _ {n} [G] ^ {n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4101827e4dd349b92d1d5aaa3260881cfd76654)
![{\ displaystyle [P] = {\ frac {c_ {P}} {1+ \ sum _ {i = 1} ^ {n} {\ beta _ {i} [G] ^ {i}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e5a5b4f3769c0ca0996d6d56e9fe287f3690918)

![{\ displaystyle [P] = {\ frac {c_ {P}} {1+ \ beta _ {1} [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b617d194d337f431f73fc11a407538b873b5d8de)