Hexokinase - Hexokinase
| Hexokinase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estruturas cristalinas da hexoquinase 1 de Kluyveromyces lactis .
| |||||||||
| Identificadores | |||||||||
| EC nº | 2.7.1.1 | ||||||||
| CAS no. | 9001-51-8 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologia Genética | AmiGO / QuickGO | ||||||||
| |||||||||
| hexoquinase 1 | |||||||
|---|---|---|---|---|---|---|---|
 Hexokinase 1, homodímero, humano
| |||||||
| Identificadores | |||||||
| Símbolo | HK1 | ||||||
| Gene NCBI | 3098 | ||||||
| HGNC | 4922 | ||||||
| OMIM | 142600 | ||||||
| RefSeq | NM_000188 | ||||||
| UniProt | P19367 | ||||||
| Outros dados | |||||||
| Locus | Chr. 10 q22 | ||||||
| |||||||
| hexoquinase 2 | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Símbolo | HK2 | ||||||
| Gene NCBI | 3099 | ||||||
| HGNC | 4923 | ||||||
| OMIM | 601125 | ||||||
| RefSeq | NM_000189 | ||||||
| UniProt | P52789 | ||||||
| Outros dados | |||||||
| Locus | Chr. 2 p13 | ||||||
| |||||||
| hexoquinase 3 (células brancas) | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Símbolo | HK3 | ||||||
| Gene NCBI | 3101 | ||||||
| HGNC | 4925 | ||||||
| OMIM | 142570 | ||||||
| RefSeq | NM_002115 | ||||||
| UniProt | P52790 | ||||||
| Outros dados | |||||||
| Locus | Chr. 5 q35.2 | ||||||
| |||||||
| Hexokinase_1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 estrutura cristalina da glucoquinase humana
| |||||||||
| Identificadores | |||||||||
| Símbolo | Hexokinase_1 | ||||||||
| Pfam | PF00349 | ||||||||
| Clã Pfam | CL0108 | ||||||||
| InterPro | IPR022672 | ||||||||
| PRÓSITO | PDOC00370 | ||||||||
| SCOP2 | 1cza / SCOPe / SUPFAM | ||||||||
| |||||||||
| Hexokinase_2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 complexo hexoquinase tipo i de cérebro de rato com glicose e inibidor de glicose-6-fosfato
| |||||||||
| Identificadores | |||||||||
| Símbolo | Hexokinase_2 | ||||||||
| Pfam | PF03727 | ||||||||
| Clã Pfam | CL0108 | ||||||||
| InterPro | IPR022673 | ||||||||
| PRÓSITO | PDOC00370 | ||||||||
| SCOP2 | 1cza / SCOPe / SUPFAM | ||||||||
| |||||||||
Uma hexoquinase é uma enzima que fosforila hexoses ( açúcares de seis carbonos ), formando hexose fosfato. Na maioria dos organismos, a glicose é o substrato mais importante para as hexocinases e a glicose-6-fosfato é o produto mais importante. A hexoquinase possui a capacidade de transferir um grupo fosfato inorgânico do ATP para um substrato.
As hexocinases não devem ser confundidas com a glucoquinase , que é uma isoforma específica da hexoquinase. Todas as hexocinases são capazes de fosforilar várias hexoses, mas a glucoquinase atua com uma afinidade de substrato 50 vezes menor e seu principal substrato de hexose é a glicose.
Variação
Genes que codificam hexoquinase foram descobertos em todos os domínios da vida e existem entre uma variedade de espécies que variam de bactérias , leveduras e plantas a humanos e outros vertebrados . Eles são categorizados como proteínas de dobra de actina , compartilhando um núcleo de sítio de ligação de ATP comum que é rodeado por sequências mais variáveis que determinam afinidades de substrato e outras propriedades.
Várias isoformas de hexoquinase ou isoenzimas que fornecem funções diferentes podem ocorrer em uma única espécie .
Reação
As reações intracelulares mediadas por hexocinases podem ser tipificadas como:
- Hexose-CH 2 OH + MgATP2−
→ Hexose-CH 2 O-PO2−
3 + MgADP-
+ H +
onde hexose-CH 2 OH representa qualquer uma das várias hexoses (como glicose) que contém uma porção acessível -CH 2 OH.
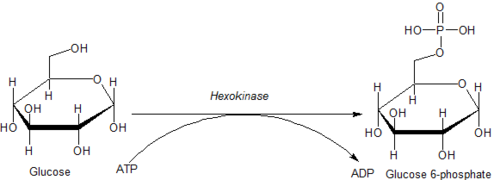
Consequências da fosforilação de hexose
A fosforilação de uma hexose, como a glicose, geralmente a limita a vários processos metabólicos intracelulares, como a glicólise ou a síntese de glicogênio . Isso ocorre porque as hexoses fosforiladas são carregadas e, portanto, mais difíceis de transportar para fora de uma célula.
Em pacientes com frutosúria essencial , o metabolismo da frutose pela hexoquinase em frutose-6-fosfato é o principal método de metabolização da frutose na dieta; esta via não é significativa em indivíduos normais.
Tamanho de diferentes isoformas
A maioria das hexocinases bacterianas tem aproximadamente 50 kD de tamanho. Organismos multicelulares, incluindo plantas e animais, geralmente têm mais de uma isoforma hexoquinase. A maioria tem cerca de 100 kD de tamanho e consiste em duas metades (terminal N e C), que compartilham muita homologia de sequência. Isso sugere uma origem evolutiva por duplicação e fusão de uma hexoquinase ancestral de 50 kD semelhante à das bactérias.
Tipos de hexoquinase de mamíferos
Existem quatro importantes isoenzimas hexoquinase de mamíferos ( EC 2.7.1.1 ) que variam em localizações subcelulares e cinética com respeito a diferentes substratos e condições, e função fisiológica. Eles são designados hexocinases I, II, III e IV ou hexocinases A, B, C e D.
Hexocinases I, II e III
As hexocinases I, II e III são referidas como isozimas de "baixo Km " devido a uma elevada afinidade para a glicose (abaixo de 1 mM). As hexocinases I e II seguem a cinética de Michaelis-Menten em concentrações fisiológicas de substratos. Todos os três são fortemente inibidos por seu produto, a glicose-6-fosfato . Os pesos moleculares são de cerca de 100 kD. Cada uma consiste em duas metades semelhantes de 50 kD, mas apenas na hexoquinase II ambas as metades têm sítios ativos funcionais.
- A hexoquinase I / A é encontrada em todos os tecidos de mamíferos e é considerada uma "enzima doméstica", não afetada pela maioria das alterações fisiológicas, hormonais e metabólicas.
- A hexoquinase II / B constitui a principal isoforma regulada em muitos tipos de células e está aumentada em muitos cânceres. É a hexoquinase encontrada no músculo e no coração. A hexoquinase II também está localizada na membrana externa da mitocôndria, de modo que pode ter acesso direto ao ATP. A atividade específica relativa da hexoquinase II aumenta com o pH, pelo menos em uma faixa de pH de 6,9 a 8,5.
- A hexoquinase III / C é inibida pelo substrato pela glicose em concentrações fisiológicas. Pouco se sabe sobre as características regulatórias desta isoforma.
Hexoquinase IV ("glucoquinase")
A hexoquinase IV de mamífero, também conhecida como glucoquinase, difere de outras hexocinases na cinética e funções.
A localização da fosforilação em um nível subcelular ocorre quando a glucoquinase se transloca entre o citoplasma e o núcleo das células do fígado . A glicocinase só pode fosforilar a glicose se a concentração desse substrato for alta o suficiente; seu Km para a glicose é 100 vezes maior do que o das hexocinases I, II e III.
A hexoquinase IV é monomérica, cerca de 50 kD, exibe cooperatividade positiva com a glicose e não é inibida alostericamente por seu produto, a glicose-6-fosfato.
A hexocinase IV está presente no fígado , pâncreas , hipotálamo , intestino delgado e talvez algumas outras células neuroendócrinas e desempenha um papel regulador importante no metabolismo de carboidratos . Nas células beta das ilhotas pancreáticas , ele atua como um sensor de glicose para controlar a liberação de insulina e, da mesma forma, controla a liberação de glucagon nas células alfa . Nos hepatócitos do fígado, a glucoquinase responde a mudanças nos níveis de glicose do ambiente aumentando ou reduzindo a síntese de glicogênio.
Em glicólise
A glicose é única, pois pode ser usada para produzir ATP por todas as células, tanto na presença quanto na ausência de oxigênio molecular (O 2 ). A primeira etapa da glicólise é a fosforilação da glicose pela hexoquinase.
| D - glicose | Hexokinase | α- D - Glicose-6-fosfato | |

|

|
||
| ATP | ADP | ||

|
|||
Composto C00031 em KEGG Pathway Database. Enzyme 2.7.1.1 no banco de dados KEGG Pathway. Composto C00668 no banco de dados KEGG Pathway. Reaction R01786 no banco de dados KEGG Pathway.
Ao catalisar a fosforilação da glicose para produzir glicose 6-fosfato, as hexocinases mantêm o gradiente de concentração descendente que favorece o transporte facilitado de glicose para as células. Esta reação também inicia todas as vias fisiologicamente relevantes de utilização da glicose, incluindo a glicólise e a via da pentose fosfato . A adição de um grupo fosfato carregado na posição 6 das hexoses também garante 'aprisionamento' de glicose e análogos de glicose 2-desoxiglicose (por exemplo, 2-desoxiglicose e 2-fluoro-2-desoxiglicose) dentro das células, pois os fosfatos de hexose carregados não podem atravessa facilmente a membrana celular.
Associação com mitocôndrias
As hexocinases I e II podem se associar fisicamente à superfície externa da membrana externa da mitocôndria por meio de ligação específica a uma porina, ou canal de ânion dependente de voltagem. Essa associação confere à hexoquinase acesso direto ao ATP gerado pela mitocôndria, que é um dos dois substratos da hexoquinase. A hexoquinase mitocondrial é altamente elevada em células tumorais malignas de crescimento rápido, com níveis até 200 vezes maiores do que os tecidos normais. Foi demonstrado que a hexoquinase mitocondrialmente ligada é a força motriz para as taxas glicolíticas extremamente altas que ocorrem aerobicamente nas células tumorais (o chamado efeito Warburg descrito por Otto Heinrich Warburg em 1930).
Trama de hidropatia
As porções transmembranares potenciais de uma proteína podem ser detectadas por análise de hidropatia. Uma análise de hidropatia usa um algoritmo que quantifica o caráter hidrofóbico em cada posição ao longo da cadeia polipeptídica. Uma das escalas de hidropatia aceitas é a de Kyte e Doolittle, que depende da geração de gráficos de hidropatia. Nestes gráficos, os números negativos representam regiões hidrofílicas e os números positivos representam regiões hidrofóbicas no eixo y. Um domínio transmembranar potencial tem cerca de 20 aminoácidos de comprimento no eixo x.
Uma análise de hidropatia de hexoquinase em levedura foi criada por esses padrões. Parece que a hexoquinase possui um único domínio transmembranar potencial localizado em torno do aminoácido 400. Portanto, a hexoquinase provavelmente não é uma proteína de membrana integral na levedura.
Deficiência
A deficiência de hexoquinase é uma doença genética autossômica recessiva que causa anemia hemolítica crônica. A anemia hemolítica crônica é causada por uma mutação no gene HK, que codifica a enzima HK. A mutação causa redução da atividade de HK, que causa deficiência de hexoquinase.
Veja também
- Allostery
- Catálise enzimática
- Linker flexível
- Biossensores fluorescentes de glicose
- Glucoquinase
- Glicolise
- Glicogênio
- Glicose 6-fosfatase
- Absorção de hexose fosfato
- Insulina
- Dinâmica do domínio da proteína
- Flexibilidade de proteína
Referências











