Cepa (química) - Strain (chemistry)
Na química , uma molécula sofre deformação quando sua estrutura química sofre algum estresse que aumenta sua energia interna em comparação com um composto de referência livre de deformação . A energia interna de uma molécula consiste em toda a energia armazenada nela. Uma molécula com tensão tem uma quantidade adicional de energia interna que uma molécula sem tensão não tem. Essa energia interna extra, ou energia de deformação , pode ser comparada a uma mola comprimida . Assim como uma mola comprimida deve ser mantida no lugar para evitar a liberação de sua energia potencial , uma molécula pode ser mantida em uma conformação energeticamente desfavorável pelas ligações dentro dessa molécula. Sem as ligações que mantêm a conformação no lugar, a energia de deformação seria liberada.
Resumo
Termodinâmica
O equilíbrio de duas conformações moleculares é determinado pela diferença na energia livre de Gibbs das duas conformações. A partir dessa diferença de energia, a constante de equilíbrio para as duas conformações pode ser determinada.
Se houver uma diminuição na energia livre de Gibbs de um estado para outro, essa transformação é espontânea e o estado de menor energia é mais estável . Uma conformação molecular altamente tensionada e de alta energia se converterá espontaneamente na conformação molecular de baixa energia.
A entalpia e a entropia estão relacionadas com a energia livre de Gibbs através da equação (a uma temperatura constante ):
A entalpia é normalmente a função termodinâmica mais importante para determinar uma conformação molecular mais estável. Embora existam diferentes tipos de cepas, a energia da cepa associada a todas elas se deve ao enfraquecimento das ligações dentro da molécula. Uma vez que a entalpia geralmente é mais importante, a entropia pode frequentemente ser ignorada. Nem sempre é o caso; se a diferença na entalpia for pequena, a entropia pode ter um efeito maior no equilíbrio. Por exemplo, o n-butano tem duas conformações possíveis, anti e gauche . A anti-conformação é mais estável em 0,9 kcal mol −1 . Esperaríamos que o butano fosse cerca de 82% anti e 18% gauche em temperatura ambiente. No entanto, existem duas conformações gauche possíveis e apenas uma anti conformação. Portanto, a entropia contribui com 0,4 kcal a favor da conformação gauche. Descobrimos que a distribuição conformacional real do butano é 70% anti e 30% gauche à temperatura ambiente.
Determinando a cepa molecular
O calor padrão de formação (Δ f H °) de um composto é descrito como a mudança de entalpia quando o composto é formado a partir de seus elementos separados. Quando o calor de formação de um composto é diferente de uma predição ou de um composto de referência, essa diferença pode frequentemente ser atribuída à deformação. Por exemplo, Δ f H ° para ciclohexano é -29,9 kcal mol -1, enquanto Δ f H ° para metilciclopentano é -25,5 kcal mol -1 . Apesar de ter os mesmos átomos e número de ligações, o metilciclopentano tem maior energia do que o ciclohexano. Esta diferença de energia pode ser atribuída à tensão do anel de um anel de cinco membros que está ausente no ciclohexano. Experimentalmente, a energia de deformação é frequentemente determinada usando calores de combustão, que normalmente é um experimento fácil de realizar.
Determinar a energia de deformação dentro de uma molécula requer conhecimento da energia interna esperada sem a deformação. Existem duas maneiras de fazer isso. Em primeiro lugar, pode-se comparar a um composto semelhante que carece de cepa, como no exemplo anterior de metilciclohexano . Infelizmente, muitas vezes pode ser difícil obter um composto adequado. Uma alternativa é usar a teoria do incremento de grupo de Benson . Desde que incrementos de grupo adequados estejam disponíveis para os átomos dentro de um composto, uma previsão de Δ f H ° pode ser feita. Se o Δ f H ° experimental difere do Δ f H ° previsto , essa diferença de energia pode ser atribuída à energia de deformação.
Tipos de tensão
Cepa Van der Waals
A cepa de Van der Waals , ou cepa estérica, ocorre quando os átomos são forçados a se aproximar mais do que seus raios de Van der Waals permitem. Especificamente, a cepa de Van der Waals é considerada uma forma de cepa em que os átomos em interação estão a pelo menos quatro ligações um do outro. A quantidade de cepa estérica em moléculas semelhantes depende do tamanho dos grupos de interação; os grupos terc-butil volumosos ocupam muito mais espaço do que os grupos metil e freqüentemente experimentam maiores interações estéricas.
Os efeitos da cepa estérica na reação de trialquilaminas e trimetilboron foram estudados pelo Prêmio Nobel Herbert C. Brown et al. Eles descobriram que, à medida que o tamanho dos grupos alquil na amina aumentava, a constante de equilíbrio também diminuía. A mudança no equilíbrio foi atribuída à tensão estérica entre os grupos alquil da amina e os grupos metil do boro.
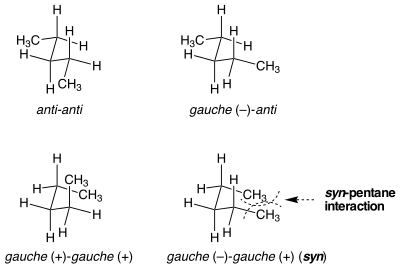
Cepa Syn-pentano
Existem situações em que conformações aparentemente idênticas não são iguais na energia de deformação. A cepa Syn-pentano é um exemplo dessa situação. Existem duas maneiras diferentes de colocar ambas as ligações da central em n- pentano em uma conformação gauche, uma das quais é 3 kcal mol- 1 mais alta em energia do que a outra. Quando as duas ligações substituídas por metil são giradas de anti para gauche em direções opostas, a molécula assume uma conformação semelhante ao ciclopentano, onde os dois grupos metil terminais são colocados em proximidade. Se as ligações são giradas na mesma direção, isso não ocorre. A tensão estérica entre os dois grupos metil terminais é responsável pela diferença de energia entre as duas conformações semelhantes, embora muito diferentes.
Cepa alílica
A cepa alílica, ou cepa A 1,3 está intimamente associada à cepa sin-pentano. Um exemplo de cepa alílica pode ser visto no composto 2-penteno . É possível que o substituinte etil da olefina gire de modo que o grupo metil terminal seja aproximado do grupo metil vicinal da olefina. Esses tipos de compostos geralmente assumem uma conformação mais linear para evitar a deformação estérica entre os substituintes.
Cepa 1,3-diaxial
Cepa 1,3-diaxial é outra forma de cepa semelhante ao sin-pentano. Neste caso, a cepa ocorre devido a interações estéricas entre um substituinte de um anel ciclohexano ('α') e interações gauche entre o substituinte alfa e ambos os carbonos de metileno duas ligações de distância do substituinte em questão (portanto, 1,3-diaxial interações). Quando o substituinte é axial , ele é aproximado de um hidrogênio gama axial. A quantidade de tensão é amplamente dependente do tamanho do substituinte e pode ser aliviada formando a conformação da cadeira principal, colocando o substituinte em uma posição equatorial. A diferença de energia entre as conformações é chamada de valor A e é bem conhecida por muitos substituintes diferentes. O valor A é um parâmetro termodinâmico e foi originalmente medido junto com outros métodos usando a equação de energia livre de Gibbs e, por exemplo, a redução de Meerwein-Ponndorf-Verley / equilíbrio de oxidação Oppenauer para a medição de valores axiais versus equatoriais de ciclohexanona / ciclohexanol ( 0,7 kcal mol −1 ).
Tensão torcional
A tensão de torção é a resistência à torção da ligação. Em moléculas cíclicas, também é chamada de cepa Pitzer .
A tensão de torção ocorre quando átomos separados por três ligações são colocados em uma conformação eclipsada em vez da conformação escalonada mais estável. A barreira de rotação entre as conformações escalonadas de etano é de aproximadamente 2,9 kcal mol -1 . Inicialmente, acreditava-se que a barreira à rotação era devido às interações estéricas entre os hidrogênios vicinais, mas o raio de Van der Waals do hidrogênio é muito pequeno para que esse seja o caso. Pesquisas recentes mostraram que a conformação escalonada pode ser mais estável devido a um efeito hiperconjugativo . A rotação para longe da conformação escalonada interrompe essa força estabilizadora.
Moléculas mais complexas, como o butano, têm mais de uma conformação escalonada possível. A anti-conformação do butano é aproximadamente 0,9 kcal mol −1 (3,8 kJ mol −1 ) mais estável do que a conformação gauche. Ambas essas conformações escalonadas são muito mais estáveis do que as conformações eclipsadas. Em vez de um efeito hiperconjugativo, como no etano , a energia de deformação no butano é devida às interações estéricas entre os grupos metil e à deformação angular causada por essas interações.
Tensão do anel
De acordo com a teoria de ligação molecular VSEPR , a geometria preferida de uma molécula é aquela em que os elétrons ligados e não ligados estão o mais distantes possível. Nas moléculas, é bastante comum que esses ângulos sejam um tanto comprimidos ou expandidos em comparação com seu valor ideal. Essa deformação é conhecida como deformação angular ou deformação de Baeyer. Os exemplos mais simples de deformação angular são pequenos cicloalcanos, como ciclopropano e ciclobutano, que são discutidos abaixo. Além disso, muitas vezes há cepa eclipsante ou Pitzer em sistemas cíclicos. Estas e as possíveis interações transanulares foram resumidas no início por HC Brown como cepa interna, ou I-Strain. A mecânica molecular ou abordagens de campo de força permitem calcular tais contribuições de deformação, que então podem ser correlacionadas, por exemplo, com taxas de reação ou equilíbrios. Muitas reações de compostos alicíclicos , incluindo reações de equilíbrio, redox e solvólise, todas caracterizadas pela transição entre os estados sp2 e sp3 no centro da reação, se correlacionam com as diferenças de energia de deformação correspondentes SI (sp2 -sp3). Os dados refletem principalmente os ângulos vicinais desfavoráveis em anéis médios, conforme ilustrado pelo aumento severo das taxas de redução da cetona com o aumento do SI (Figura 1). Outro exemplo é a solvólise de tosilatos de cabeça de ponte com diferenças de energia estérica entre os derivados de brometo correspondentes (sp3) e o íon carbênio como modelo sp2- para o estado de transição. (Figura 2)
| Tamanho do anel | Energia de deformação (kcal mol -1 ) | Tamanho do anel | Energia de deformação (kcal mol -1 ) | |
|---|---|---|---|---|
| 3 | 27,5 | 10 | 12,4 | |
| 4 | 26,3 | 11 | 11,3 | |
| 5 | 6,2 | 12 | 4,1 | |
| 6 | 0,1 | 13 | 5,2 | |
| 7 | 6,2 | 14 | 1,9 | |
| 8 | 9,7 | 15 | 1,9 | |
| 9 | 12,6 | 16 | 2.0 |
Em princípio, a deformação angular pode ocorrer em compostos acíclicos, mas o fenômeno é raro.
Anéis pequenos
O ciclohexano é considerado uma referência na determinação da deformação do anel em cicloalcanos e é comumente aceito que há pouca ou nenhuma energia de deformação. Em comparação, cicloalcanos menores têm energia muito mais alta devido ao aumento da tensão. Ciclopropano é análogo a um triângulo e, portanto, tem ângulos de ligação de 60 ° C, muito mais baixa do que a 109,5 ° preferido de um sp 3 carbono hibridizado. Além disso, os hidrogênios no ciclopropano são eclipsados. O ciclobutano experimenta deformações semelhantes, com ângulos de ligação de aproximadamente 88 ° (não é completamente plano) e hidrogênios eclipsados. A energia de deformação do ciclopropano e do ciclobutano são 27,5 e 26,3 kcal mol −1 , respectivamente. O ciclopentano sofre muito menos deformação, principalmente devido à deformação torcional de hidrogênios eclipsados, e tem uma energia de deformação de 6,2 kcal mol -1 .
A tensão do anel pode ser consideravelmente maior em sistemas bicíclicos . Por exemplo, o biciclobutano , C 4 H 6 , é conhecido por ser um dos compostos mais tensos que é isolável em grande escala; sua energia de deformação é estimada em 63,9 kcal mol −1 (267 kJ mol −1 ).
Cepa transanular
Anéis de tamanho médio (7–13 carbonos) experimentam mais energia de deformação do que o ciclohexano, devido principalmente ao desvio dos ângulos vicinais ideais ou deformação de Pitzer. Cálculos de mecânica molecular indicam que a deformação transanular, também conhecida como deformação Prelog , não desempenha um papel essencial. Reações transanulares, no entanto, como 1,5-shifts em reações de substituição de ciclooctano, são bem conhecidas.
Sistemas bicíclicos
A quantidade de energia de deformação em sistemas bicíclicos é comumente a soma da energia de deformação em cada anel individual. Nem sempre é o caso, pois às vezes a fusão dos anéis induz alguma tensão extra.
Cepa em sistemas alostéricos
Em sistemas alostéricos sintéticos , normalmente existem dois ou mais conformadores com diferenças de estabilidade devido às contribuições de deformação. A cooperatividade positiva, por exemplo, resulta do aumento da ligação de um substrato A a um conformador C2 que é produzido pela ligação de uma molécula efetora E. Se o conformador C2 tiver uma estabilidade semelhante a outro conformador C1 de equilíbrio, um ajuste induzido pelo substrato A levará a ligação de A a C2 também na ausência do efetor E. Somente se a estabilidade do conformador C2 for significativamente menor, o que significa que na ausência de um efetor E a população de C2 é muito menor do que a de C1, a razão K2 / K1 que mede a eficiência do sinal alostérico aumentará. A razão K2 / K1 pode ser relacionada diretamente à diferença de energia de deformação entre os conformadores C1 e C2; se for pequeno, concentrações mais altas de A irão se ligar diretamente a C2 e tornar o efetor E ineficiente. Além disso, o tempo de resposta de tais comutadores alostéricos depende da deformação do estado de transições de interconversão do conformador.