Triacetato de alumínio - Aluminium triacetate
| Nomes | |
|---|---|
|
Nome IUPAC
Acetato de alumínio
|
|
| Outros nomes
Acetato de alumínio (III)
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100,004.868 |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
| Propriedades | |
| C 6 H 9 Al O 6 | |
| Massa molar | 204,114 g · mol −1 |
| Aparência | sólido branco |
| solúvel | |
| Compostos relacionados | |
|
Compostos relacionados
|
Diacetato de alumínio básico ( diacetato de hidroxialumínio), CAS RN 142-03-0, HOAl (CH 3CO 2) 2 Monoacetato de alumínio dibásico (acetato de dihidroxialumínio), CAS RN 7360-44-3, (HO) 2AlCH 3CO 2 |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
| Referências da Infobox | |
O triacetato de alumínio , formalmente denominado acetato de alumínio , é um composto químico com composição Al (CH
3CO
2)
3. Sob condições padrão, ele aparece como um sólido branco solúvel em água que se decompõe quando aquecido a cerca de 200 ° C. O triacetato hidrolisa em uma mistura de sais básicos de hidróxido / acetato e várias espécies coexistem em equilíbrio químico , particularmente em soluções aquosas do íon acetato; o nome acetato de alumínio é comumente usado para este sistema misto.
Tem aplicações terapêuticas por suas propriedades anti-coceira, adstringente e anti - séptica e, como uma preparação de venda livre como a solução de Burow , é usado para tratar infecções de ouvido . As preparações da solução de Burow foram diluídas e modificadas com aminoácidos para torná-las mais palatáveis para uso como gargarejos para doenças como úlceras aftosas da boca. Na medicina veterinária , a propriedade de adstringência do triacetato de alumínio é usada para tratar a doença de Mortellaro em animais com cascos, como o gado.
O triacetato de alumínio é usado como um agente mordente com corantes como a alizarina , tanto sozinho quanto em combinação. Junto com o diacetato de alumínio ou com o sulfacetato de alumínio é usado com algodão , outras fibras de celulose e seda . Também foi combinado com acetato ferroso para produzir cores diferentes.
Nomenclatura
De acordo com as regras formais para nomear compostos inorgânicos , o nome para Al (CH
3CO
2)
3é acetato de alumínio, embora nomes mais formais como acetato de alumínio (III) e etanoato de alumínio sejam aceitáveis. O uso do prefixo multiplicador "tri" no nome triacetato de alumínio, embora não seja tecnicamente necessário, é usado regularmente para evitar confusão potencial com compostos relacionados com hidroxigantes . O diacetato de alumínio básico , formalmente diacetato de hidroxialumínio ( CAS RN 142-03-0), tem composição HOAl (CH
3CO
2)
2com um ligante hidroxilado no lugar de um ligante de acetato e monoacetato de alumínio dibásico , formalmente acetato de dihidroxialumínio (CAS RN 7360-44-3), tem composição (HO)
2AlCH
3CO
2com apenas um ligante de acetato. Esses três compostos são distintos na fase sólida, mas são geralmente tratados como um grupo e descritos coletivamente como acetato de alumínio em solução, devido à hidrólise do triacetato em uma mistura que inclui as outras duas formas. A abreviatura como AlAc, junto com variantes como AlAc2+
e AlAc+
2, às vezes são usados na disciplina de geoquímica , embora sejam inconsistentes com a prática padrão da química convencional .
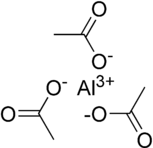
Estrutura
A fórmula Al (CH
3CO
2)
3indica a presença de centros metálicos de alumínio no estado de oxidação +3 e grupos acetato em uma proporção de 1: 3. As imagens usadas para representar esta substância, como as mostradas à esquerda, representam duas aproximações altamente simplificadas da estrutura de estado sólido: a primeira é como um sal puramente iônico com um único cátion alumínio (III) (Al 3+ ) rodeado por e associado eletrostaticamente com três ânions acetato ( CH
3CO-
2), mas isso não deve ser interpretado como uma forma de transmitir informações sobre a estrutura do cristal . Por exemplo, o cloreto de sódio (NaCl) tem uma estequiometria cátion-a-ânion de 1: 1, mas tem uma estrutura cúbica com cada íon rodeado octaedricamente por seis íons de carga oposta.
A outra imagem é uma forma molecular com os três grupos de acetato covalentemente ligados ao centro do metal em uma geometria planar trigonal e interações intermoleculares que mantêm as moléculas juntas umas com as outras na estrutura cristalina. É altamente provável que a estrutura de estado sólido seja mais complicada e inclua características covalentes e iônicas e é possível que vários centros de alumínio e / ou grupos de acetato em ponte possam estar presentes - ambos foram relatados em solução de acetato de alumínio e cloreto de alumínio é conhecido por existir como um Al
2Cl
6 dímero .
As investigações de NMR do sistema aquoso de alumínio (III) / acetato mostram a presença de alumínio como um complexo hexaaqua , [Al (H
2O)
6]3+
, bem como espécies mononucleares com diferentes substituições. Além disso, as investigações demonstram que uma espécie significativa em fase de solução é um Al
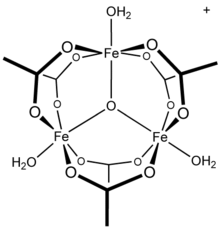
13 tridecâmero , uma porção relatada em mecanismos conflitantes de soluções de hidrólise e polimerização de alumínio. Outros cátions metálicos trivalentes são conhecidos por formar espécies polinucleares: o acetato de ferro (III) , por exemplo, forma uma estrutura trinuclear com um centro oxo triplamente ligado com o cátion [Fe 3 ( μ 3 –O) (OAc) 6 (H 2 O) 3 ] + . O composto hidróxido de acetato de cromo , Cr 3 (OH) 2 (OAc) 7 , também foi descrito como isoestrutural. São conhecidos compostos análogos de rutênio (III), vanádio (III), ródio (III) e irídio (III) com estruturas trinucleares. Cobre (II) acetato e de crómio (II), acetato de ambos têm dinucleares estruturas de di-hidrato, H 2 (OAc) 4 (H 2 O) 2 , assim como o ródio (II) acetato de etilo ; cada um mostra interações significativas de ligação metal-metal.
Química
Preparação
De acordo com o Manual de compostos inorgânicos do CRC, o triacetato de alumínio é um sólido branco, solúvel em água e geralmente preparado a partir de cloreto de alumínio ou diretamente do alumínio por aquecimento em uma solução de ácido acético com anidrido acético .
- 3 CH
3COOH + AlCl
3 → Al (CH
3CO
2)
3 + 3 HCl
- 6 CH
3COOH + 2 Al → 2 Al (CH
3CO
2)
3 + 3 H
2
Teoricamente, todas as / acetato / hidróxido de alumínio sais podem ser preparados a partir de hidróxido de alumínio ou aluminato de sódio e ácido acético, mas a formação do triacetato ocorre apenas na ausência de água. Em soluções, o diacetato é o principal produto formado e também é produzido quando o cloreto de alumínio é tratado com uma solução de acetato de sódio em condições básicas. As equações para esses processos são:
- 2 CH
3CO
2Na + Al (OH)
3 → Al (CH
3CO
2)
2OH + 2 NaOH
- 2 CH
3CO
2Na + AlCl
3 + NaOH → Al (CH
3CO
2)
2OH + 3 NaCl
- 2 CH
3CO
2Na + NaAlO
2 + 2 H
2O → Al (CH
3CO
2)
2OH + 3 NaOH
Um processo aprimorado usando uma combinação de cloreto de alumínio e aluminato de sódio com acetato de sódio preparado in situ foi patenteado :
- 29 NaAlO
2 + 10 NaOH + 84 CH
3COOH + 13 AlCl
3 → 42 Al (CH
3CO
2)
2OH + 39 NaCl + 26 H
2O
Os mordentes triacetato de alumínio e sulfacetato de alumínio podem ser preparados a partir de sulfato de alumínio , sendo o produto formado determinado pela quantidade de acetato de chumbo (II) utilizada:
-
Al
2(TÃO
4)
3 + 3 Pb (CH
3CO
2)
2 → 2 Al (CH
3CO
2)
3 + 3 PbSO
4
-
Al
2(TÃO
4)
3 + 2 Pb (CH
3CO
2)
2 → Al
2TÃO
4(CH
3CO
2)
4 + 2 PbSO
4
Decomposição
No aquecimento, o triacetato de alumínio se decompõe acima de 200 ° C em um processo semelhante ao do formiato de alumínio . O processo começa com a perda de anidrido acético ( Ac
2O ) entre 120 e 140 ° C para formar uma mistura de acetatos de óxido básico, como Al
2O (CH
3CO
2)
4e Al
3O (CH
3CO
2)
7, que são finalmente transformados em Al
2O
3( alumina ), primeiro como um sólido anidro amorfo e depois através de outras fases sólidas ( formas de cristal γ-, δ- e θ- ) para finalmente se tornar α- Al polimórfico
2O
3:
- 2 Al (CH
3CO
2)
3 → Al
2O (CH
3CO
2)
4 + CH
3CO (O) COCH
3 → Al
2O
3 + 3 CH
3CO (O) COCH
3
- 2 Al (CH
3CO
2)
2OH → Al
2O
3 + 2 CH
3COOH + CH
3CO (O) COCH
3
Hidrólise
O triacetato de alumínio hidrolisa para produzir os acetatos de hidróxido mono- e di-básico em solução ou por higroscopia :
-
Al (CH
3CO
2)
3 + H
2O → Al (CH
3CO
2)
2OH + CH
3COOH
-
Al (CH
3CO
2)
3 + 2 H
2O → Al (CH
3CO
2)(OH)
2 + 2 CH
3COOH
Usos
De acordo com o National Cancer Institute , os acetatos de alumínio são usados topicamente em humanos como agentes anti-sépticos , que também causam o encolhimento dos tecidos do corpo . Sua propriedade de adstringência também é usada para tratar a doença de Mortellaro em animais com cascos, como o gado. O acetato de alumínio promove a cura da pele infectada e também auxilia na inflamação , coceira e ardência. A Food and Drug Administration aprovou seu uso para "alívio temporário de irritações cutâneas menores devido a ... ' hera venenosa ', 'carvalho venenoso', ' sumagre venenoso ', 'picadas de inseto', ' pé de atleta ' ou ' erupções cutâneas causadas por sabões, detergentes, cosméticos ou joias. '"Para essas aplicações, as preparações de venda livre , como a solução de Burow, são normalmente usadas, enquanto as formas diluídas são usadas como gargarejos para doenças como úlceras aftosas da boca, incluindo aditivos de aminoácidos para melhorar a palatabilidade e o sabor . O uso mais comum da solução de Burow é no tratamento de infecções de ouvido, incluindo otomicose , embora geralmente não seja tão eficaz quanto o clotrimazol nessas infecções fúngicas. O pó adstringente tópico Domeboro contém sulfato de alumínio tetradeca-hidratado , [Al (H
2O)
6]
2(TÃO
4)
3• 2H
2O , e mono-hidrato de acetato de cálcio , Ca (CH
3CO
2)
2• H
2O , e forma uma solução de acetato de alumínio semelhante à solução de Burow quando dissolvido. As soluções Domeboro em água morna podem ser usadas em casos de unhas encravadas , para reduzir a irritação e conter qualquer infecção que possa estar presente.
Mordente

2O) (OH) Az
2] • 2H
2O , que a alizarina se forma com um mordente de alumínio
Um mordente é uma substância usada para fixar as tinturas em tecidos ou seções de tecido, formando um complexo de coordenação com a tinta, que subsequentemente se liga ao tecido ou tecido. Um mordente freqüentemente contém um íon metálico polivalente , comumente alumínio ou ferro, como é o caso das misturas de triacetato de alumínio com sulfacetato de alumínio ou com diacetato de alumínio básico. Mordentes de triacetato de alumínio têm sido usados com algodão , outras fibras à base de celulose e seda . Eles também foram combinados com acetato ferroso para produzir cores diferentes.

2Al (μ-OH)
2AlAz
2Ca
No caso do corante alizarina (1,2-di-hidroxi antraquinona , H
2Az ), foi sugerido que a mordedura envolvia a formação de um dianião de alizarina. Isso formaria um complexo de alumínio de cinco coordenadas, CaAl (OH) Az
2, que pode absorver água para formar um hidrato com um dianião centrado em alumínio de seis coordenadas, Ca [Al (H
2O) (OH) Az
2] • 2H
2O . A proposta foi baseada em dados espectroscópicos de infravermelho , e posteriormente foi desafiada por um trabalho que sugere uma estrutura com dois ligantes hidroxila em ponte conectando um núcleo dinuclear, Az
2Al (μ-OH)
2AlAz4−
2, com duas metades de alizarina, cada uma quelando para cada centro de alumínio. A estrutura foi proposta por Soubayrol et al. com base em evidências de espectroscopia de RMN de 27 Al e espectrometria de massa de ionização por eletropulverização . Eles relataram que o grau de hidratação era dependente da identidade do contra-íon, com o sal de sódio sendo um tetra-hidrato estável com um monohidrato sendo formado a partir do hidróxido de potássio . Estes foram distinguíveis com base em suas mudanças químicas , sugerindo que as águas estão associadas aos centros de alumínio ou às metades de alizarina, e não se comportando como é típico para águas de cristalização .
Uma estrutura relacionada com íons de cálcio foi relatada em 1994, e nela as alizarinas quelam aos íons de cálcio para formar pontes AzCaAz entre os centros de alumínio (que também são ligados por grupos hidroxo) e os centros de alumínio subsequentemente ligam-se aos resíduos de fenol desprotonados de o corante; no modelo de Soubayrol, cada alizarina está associada a um único cátion alumínio. Tal como acontece com a própria estrutura do acetato de alumínio, as formas que assume nas aplicações não foram resolvidas.
Notas
a Este "Ac" não está se referindo ao elementoactínio. Usado desta forma, a convenção emquímica orgânicaé para Ac se referir aogrupoacetil, cujaformaradicaléCH
3CO e OAc ou AcO seriam usados para o radical acetato , CH
3CO
2, às vezes também chamado de "acetoxi". O íon acetato seria então AcO - , CH
3CO-
2, e o ácido acético seria AcOH ou HOAc. Sob esta convenção, o triacetato de alumínio seria Al (OAc) 3 . Publicações em geoquímica , no entanto, estão usando Ac para se referir a acetato em vez de acetil e, portanto, AlAc+
2em geoquímica seria escrito sob convenções químicas mais usuais como [Al (OAc)
2]+
ou [Al (CH
3CO
2)
2]+
.