Síntese total de Nicolaou Taxol - Nicolaou Taxol total synthesis

A síntese total de Nicolaou Taxol , publicada por KC Nicolaou e seu grupo em 1994, diz respeito à síntese total de Taxol . O taxol é um medicamento importante no tratamento do câncer, mas também caro porque o composto é obtido de um recurso escasso, ou seja, o teixo do pacífico .
Esta rota sintética para o taxol é uma de várias; outros grupos têm apresentado suas próprias soluções, notadamente o grupo de Holton com uma síntese linear a partir do borneol , o grupo Samuel Danishefsky a partir da cetona Wieland-Miescher e o grupo Wender do pineno .
A síntese de Nicolaou é um exemplo de síntese convergente porque a molécula é montada a partir de três sintons pré-montados. Duas partes principais são os anéis A e C do ciclohexênio, que são conectados por duas pontes curtas, criando um anel de 8 membros no meio (anel B). A terceira parte pré-montada é uma cauda de amida . O anel D é um anel oxetano fundido ao anel C. Duas transformações químicas essenciais são a reação de Shapiro e a reação de acoplamento pinacol . A síntese geral foi publicada em 1995 em uma série de quatro artigos.
Retrosíntese
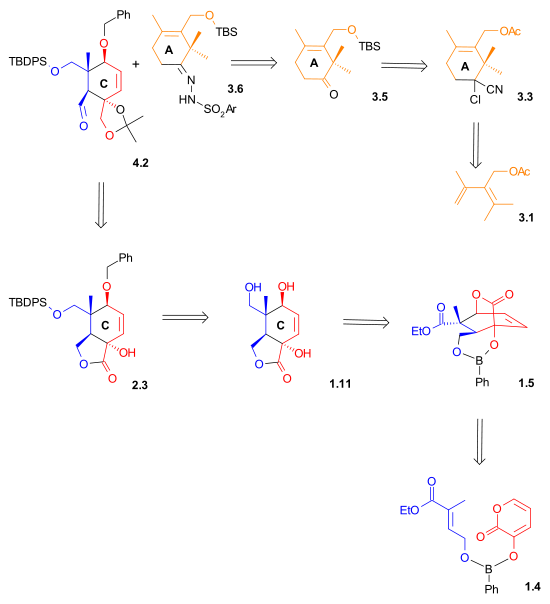
Conforme ilustrado no Esquema Retrosintético I, o Taxol foi derivado do diol 7.2 por uma formação de ligação éster, de acordo com o método Ojima-Holton. Este diol vem do carbonato 6,3 pela adição de fenilítio . O oxetano anel no composto 6.3 foi obtido através de um S N 2 de reacção envolvendo um mesilato derivado de acetal de 4,9. O anel B foi fechado por meio de uma reação de McMurry envolvendo dialdeído 4.8, que em última análise foi derivado do aldeído 4.2 e hidrazona 3.6 usando uma reação de acoplamento de Shapiro .
| Esquema de Retrosíntese 1 |
|---|
O Esquema Retrosintético II indica que tanto o aldeído quanto a hidrazona usados na reação de acoplamento de Shapiro foram sintetizados usando reações de Diels-Alder .
| Esquema de Retrosíntese 2 |
|---|
Síntese do anel C
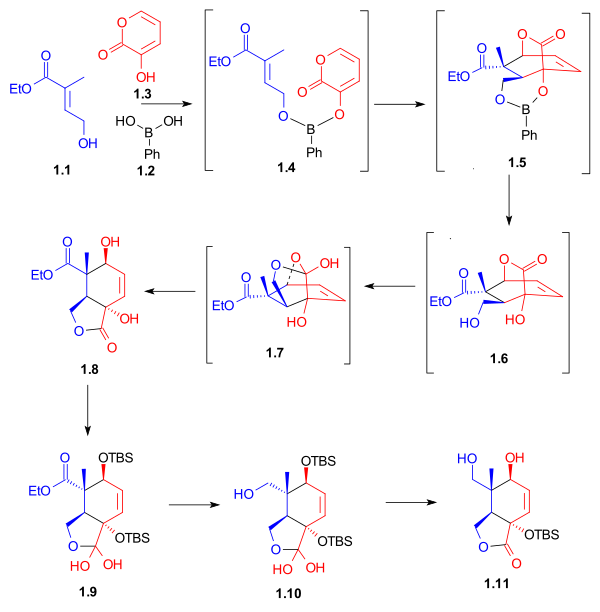
Conforme mostrado no Esquema 1 , a síntese do anel do anel C começou com uma reação de Diels-Alder entre o dieno 1.3 e o dienófilo 1.1 na presença de ácido fenilborônico ( 1.2 ), que, após adição de 2,2-dimetil-1,3- propanodiol, deu lactona de cinco membros 1,8 com 62% de rendimento. O boro serviu como uma corrente molecular e alinhou o dieno e o dienófilo para esta cicloadição de endo Diels-Alder . Após proteção dos grupos hidroxila como éteres terc- butildimetilsilila , redução do éster com hidreto de alumínio e lítio e desproteção seletiva do grupo hidroxila secundário deu lactona diol 1.11 . Os hidratos de lactona incomuns 1.9 e 1.10 foram isolados como intermediários sintéticos neste processo.
| Esquema 1 |
|---|
Lactona diol 2.1 , após proteção seletiva, foi reduzido com hidreto de alumínio e lítio para dar triol 2.4 . Este triol, após conversão ao acetonido , foi seletivamente oxidado ao aldeído usando perrutenato de tetrapropilamônio (TPAP) e N-óxido de N-metilmorfolina . O aldeído 2.6 serviu como ponto de partida para a construção do anel B ( Esquema 4 , composto 4.2 ).
| Esquema 2 |
|---|
Uma síntese de anel
A síntese de um anel ( Esquema 3 ) começou com uma reacção de Diels-Alder de dieno 3.1 com o dienófilo disponível comercialmente 2-cloroacrilonitrilo 3,2 para dar ciclohexeno 3,3 com completa regiosselectividade . A hidrólise do grupo cianocloro e a clivagem simultânea do grupo acetato levaram à hidroxicetona 3.4 . O grupo hidroxila foi protegido como um éter terc-butildimetilsilílico ( 3,5 ). Em preparação para uma reação de Shapiro , esta cetona foi convertida em hidrazona 3.6 .
| Esquema 3 |
|---|
Síntese do anel B
O acoplamento do anel A e do anel C criou o anel B de 8 membros. Uma conexão foi feita por meio de uma adição nucleofílica de um composto de vinil - lítio a um aldeído e a outra conexão por meio de uma reação de acoplamento de pinacol de dois aldeídos ( Esquema 4 ).
Uma reação de Shapiro do composto de vinil-lítio derivado da hidrazona 4.1 com o aldeído 4.2 faz a primeira conexão que se tornará o anel B. O controle da estereoquímica em 4.3 é pensado para ser derivado do impedimento relativo da face de Si na orientação mostrada à direita, devido à proximidade do grupo metila axial. A epoxidação com vanadil (acetilacetato) converteu o alceno 4.3 em epóxido 4.4 , que, após redução com hidreto de alumínio e lítio , deu diol 4.5 . Este diol foi então protegido como éster carbonato 4.6 . O grupo carbonato também serviu para criar rigidez na estrutura do anel para a reação de acoplamento do pinacol iminente . As duas éter silil grupos foram removidos, e diol 4,7 foi depois oxidado para dar o dialdeído 4.8 utilizando N -metilmorfolina N -óxido na presença de uma quantidade catalítica de perrutenato de tetrapropilamónio . Na etapa final da formação do Anel B, um acoplamento de pinacol usando as condições desenvolvidas por McMurry ( cloreto de titânio (III) e uma liga de zinco / cobre ) deu diol 4,9 .
| Esquema 4 |
|---|
Resolução
Nesse ponto da síntese do Taxol, o material era uma mistura racêmica . Para obter o enantiômero desejado , o álcool alílico 4.9 foi acilado com (1S) - (-) - cloreto campânico e dimetilaminopiridina , dando dois diastereômeros . Estes foram então separados usando cromatografia em coluna padrão . O enantiómero desejado foi então isolado quando um dos disatereómeros separados foi tratado com bicarbonato de potássio em metanol .
| Resolução enantiomérica de 4,9 . |
Síntese do anel D
O enantiómero desejado da resolução, álcool alílico 5.1 ( Esquema 5 ), foi acetilado com anidrido acético e 4- (dimetilamino) piridina em cloreto de metileno para produzir monoacetato 5.2 . Vale ressaltar que essa reação foi exclusiva para o álcool alílico, e o grupo hidroxila adjacente não foi acetilado . O álcool 5,2 foi oxidado com perrutenato de tetrapropilamônio e N-óxido de N-metilmorfolina para dar a cetona 5,3 . O alceno 5.3 foi submetido a hidroboração em tetra-hidrofurano . A oxidação com peróxido de hidrogênio básico e bicarbonato de sódio deu álcool 5,4 com rendimento de 35%, com rendimento de 15% de um regioisômero. O acetonido foi removido, dando triol 5,5 . Este álcool foi monoacetilado, para dar o acetato 5,6 . O grupo benzil foi removido e substituído por um grupo trietilsilil. Diol 5.7 foi seletivamente ativado usando cloreto de metanossulfonil e 4- (dimetilamino) piridina para dar mesilato 5,8 , com rendimento de 78%.
| Esquema 5 |
|---|
O grupo acetil em 6.1 ( Esquema 6 ) foi removido para dar álcool primário 6.2 . O anel de Taxol (D) foi adicionado por uma substituição nucleofílica intramolecular envolvendo este grupo hidroxila para dar oxetano 6,3 . Após a acetilação, fenil-lítio foi usado para abrir o anel de éster carbonato para dar álcool 6,5 . A oxidação alílica com clorocromato de piridínio , acetato de sódio e celite deu cetona 6,6 , que foi subsequentemente reduzida usando boro-hidreto de sódio para dar álcool secundário 6,7 . Este foi o último composto antes da adição da cauda de amida .
| Esquema 6 |
|---|
Adição de cauda
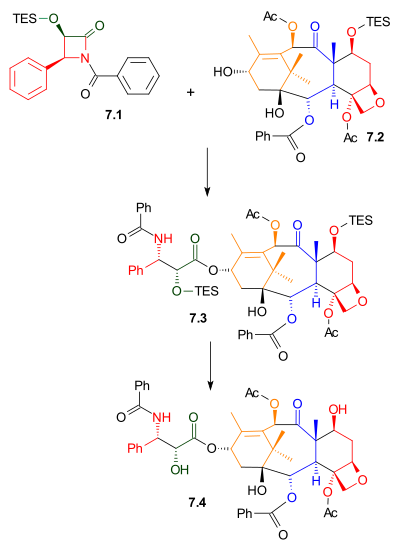
Como mostrado no Esquema 7 , Ojima lactam 7.1 reagiu com álcool 7.2 com bis (trimetilsilil) amida de sódio como uma base. Este álcool é o éter trietilsilílico do composto de ocorrência natural bacatina III. O composto relacionado, 10-desacetilbacatina III, é encontrado em Taxus baccata , também conhecido como teixo europeu, em concentrações de 1 grama por quilograma de folhas. A remoção do grupo protector trietilsililo deu Taxol.
| Esquema 7 |
|---|
Síntese de precursor
Síntese do dienófilo Diels-Alder para o Anel C
O éster etílico do ácido propiônico ( 1 ) foi bromado e depois convertido no reagente de Wittig usando trifenilfosfina . O aldeído 6 foi obtido a partir do álcool alílico ( 4 ) por proteção como o éter terc-butildifenilsilílico ( 5 ) seguido por ozonólise . O reagente de Wittig 3 e o aldeído 6 reagiram em uma reação de Wittig para dar o éster insaturado 7 , que foi desprotegido para dar o dienófilo 8 (Esquema 1, composto 1).
Síntese do dieno Diels-Alder para o Anel A
A condensação aldólica de acetona e acetoacetato de etila deu β-ceto-éster 3 . Uma reação de Grignard envolvendo brometo de metilmagnésio forneceu álcool 4 , que foi submetido à eliminação catalisada por ácido para dar dieno 5 . A redução e acilação deram dieno 7 (Esquema 3, composto 1).
Protegendo grupos
Ac (acetil)
Proteção: anidrido acético , piridina , 4- (dimetilamino) piridina e diclorometano
Desproteção: Carbonato de potássio em metanol e solvente de água
A proteção evitou a mesilação do oxigênio primário em 5.8 .
Acetonida
Proteção: 2,2-dimetoxipropano e ácido canforsulfônico e diclorometano
Desproteção: ácido clorídrico , metanol, água e éter etílico
A proteção do diol vicinal 2.4 permitiu que o grupo hidroxila remanescente no álcool 2.5 fosse seletivamente oxidado para dar o aldeído 2.6 . O acetonido foi removido muito mais tarde na síntese em preparação para o fechamento do anel D.
Bn (benzil)
Proteção: Hidreto de potássio , iodeto de tetra-n-butilamônio e brometo de benzila .
Desproteção: Hidrogênio, Pd (OH) 2 / C
O álcool secundário 2.2 foi protegido como o éter benzílico para que a redução da lactona 2.3 pudesse ocorrer. A proteção foi removida muito mais tarde na síntese para formar o álcool 5.7 , que foi reprotegido como éter trietilsilílico.
Ester Carbonato
Proteção: hidreto de potássio , fosgênio
Desproteção: O fenilítio abre o anel éster carbonato para dar o álcool 6,5 .
A proteção adiciona rigidez na estrutura do anel para a reação de acoplamento do pinacol formando diol 4.9 , e também evita oxidação indesejada na formação de dialdeído 4.8 .
Proteção: Cloreto de terc- butildifenilsilil, imidazol e dimetilformamida .
Desproteção: fluoreto de tetra-n-butilamônio
O álcool primário 2.1 foi protegido na preparação para a redução da lactona em 2.3 . O grupo protetor foi removido para dar diol 4.7 em preparação para a reação de acoplamento de pinacol .
TBS (terc-butildimetilsilil) [1]
Proteção: Triflato de terc-butildimetilsilil, lutidina , 4- (dimetilamino) piridina e diclorometano.
Desproteção: ácido canforsulfônico , diclorometano e metanol.
O grupo hidroxila secundário em 1.8 foi brevemente protegido durante a proteção de um grupo hidroxila terciário no mesmo composto.
TBS (terc-butildimetilsilil) [2]
Proteção: Triflato de terc-butildimetilsilil, lutidina, 4- (dimetilamino) piridina e diclorometano.
Desproteção: ácido canforsulfônico
A proteção do grupo hidroxila terciário em 1.8 foi necessária para permitir a proteção seletiva de outros grupos hidroxila no anel C.
TBS (terc-butildimetilsilil) [3]
Proteção: Diclorometano, imidazol e cloreto de terc-butildimetilsilila.
Desproteção: fluoreto de tetra-n-butilamônio
A proteção do grupo hidroxila em 3.4 permitiu que a cetona sofresse uma reação de Shapiro para formar o composto de viilítio 3.7 .
TES (trietilsilil) [1]
Proteção: Cloreto de trietilsilila e piridina .
Desprotecção: Hidrólise com ácido fluorídrico , piridina e tetrahidrofurano.
A proteção do grupo hidroxila secundário em 5.7 foi necessária para a adição final da cauda ao álcool 7.2 .
TES (trietilsilil) [2]
Proteção: Veja Ojima lactam .
Desproteção: hidrólise usando ácido fluorídrico e piridina
Álcool secundário protegido em Ojima lactam 7.1 durante a reação com o álcool 7.2 na adição da cauda.
Veja também
- Síntese total de paclitaxel
- Síntese total de Danishefsky Taxol
- Síntese total de Holton Taxol
- Síntese total de Kuwajima Taxol
- Síntese total de Mukaiyama Taxol
- Síntese total de Wender Taxol