Síntese total de Mukaiyama Taxol - Mukaiyama Taxol total synthesis

A síntese total de taxol Mukaiyama publicada pelo grupo de Teruaki Mukaiyama da Universidade de Ciência de Tóquio entre 1997 e 1999 foi a sexta síntese total de taxol bem-sucedida . A síntese total do Taxol é considerada uma marca registrada na síntese orgânica .
Esta versão é uma síntese linear com a formação do anel ocorrendo na ordem C, B, A, D. Ao contrário dos outros métodos publicados, a síntese da cauda é por um projeto original. Teruaki Mukaiyama é um especialista em reações aldólicas e, não surpreendentemente, sua versão do Taxol contém nada menos que 5 dessas reações. Outras reações-chave encontradas nesta síntese são um acoplamento pinacol e uma reação Reformatskii . Em termos de matérias-primas, a estrutura C20 é construída a partir de L-serina (C3), ácido isobutírico (C4), ácido glicólico (C2), brometo de metila (C1), iodeto de metila (C1), 2,3-dibromopropeno (C3 ), ácido acético (C2) e brometo de homoalil (C4).
Anel C de Síntese
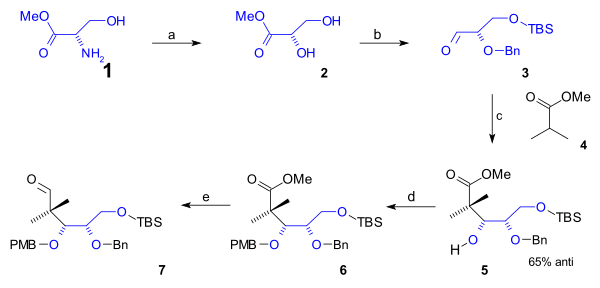
A borda inferior do anel B do ciclo - octano contendo os primeiros 5 átomos de carbono foi sintetizada em uma semissíntese começando a partir da L-serina de ocorrência natural ( esquema 1 ). Esta via começou com a conversão do grupo amino do éster metílico da serina ( 1 ) para o éster diol 2 via diazotização ( nitrito de sódio / ácido sulfúrico ). Após a proteção do grupo álcool primário para um éter silílico (t-butildimetil) TBS ( TBSCl / imidazol ) e do grupo álcool secundário com um (Bn) éter benzílico ( imidato de benzila , ácido triflico ), o aldeído 3 foi reagido com o éster metílico do ácido isobutírico ( 4 ) em adição de Aldol ao álcool 5 com 65% de estereosseletividade . Este grupo foi protegido como um PMB (p-metoxibenzil) éter (novamente através de um imidato ) em 6 que permitiu a redução orgânica do éster ao aldeído em 7 com DIBAL .
| Esquema 1 |
|---|
A conclusão do anel ciclo-octano exigiu mais 3 átomos de carbono que foram fornecidos por um fragmento C2 em uma adição de aldol e um fragmento Grignard C1 ( esquema 2 ). Uma adição de aldol Mukaiyama ( brometo de magnésio / tolueno ) ocorreu entre o aldeído 7 e silil acetal 8 de ceteno com 71% de estereosseletividade ao álcool 9 que foi protegido como o éter de TBS 10 ( TBSOTf , 2,6-lutidina ). O grupo éster foi reduzido com DIBAL a um álcool e depois oxidado de volta ao aldeído 11 por oxidação de Swern . A alquilação por brometo de metilmagnésio em álcool 12 e outra oxidação de Swern deu a cetona 13 . Este grupo foi convertido no silil enol éter 14 ( LHMDS , TMSCl ) permitindo-lhe reagir com NBS para o brometo de alquil 15 . O grupo C20 metil foi introduzido como iodeto de metil em uma substituição nucleofílica com uma base forte ( LHMDS em HMPA ) no brometo 16 . Em seguida, na preparação para o fechamento do anel, o éter de TBS foi desprotegido ( HCl / THF ) a um álcool que foi convertido no aldeído 17 em uma oxidação de Swern . A reação de fechamento do anel foi uma reação Reformatskii com iodeto de Samário (II) e ácido acético em acetato 18 . A estereoquímica desta etapa em particular não teve consequência porque o grupo acetato é desidratado no alceno 19 com DBU em benzeno .
| Esquema 2 |
|---|
Anel B de Síntese
O fragmento C5 24 necessário para a síntese do anel C ( esquema 3 ) foi preparado a partir de 2,3-dibromopropeno ( 20 ) por reação com acetato de etila ( 21 ), n- butil - lítio e um sal de cobre, seguido por redução orgânica de acetato 22 ao álcool 23 ( hidreto de alumínio e lítio ) e sua sililação TES . A adição de Michael de 24 com o ciclo-octano 19 a 25 com t-BuLi foi catalisada por cianeto de cobre . Após a remoção do grupo TES (HCl, THF), o álcool 26 foi oxidado ao aldeído 27 ( TPAP , NMO ) que possibilitou a reação intramolecular do Aldol ao bicicletário 28 .
| Esquema 3 |
|---|
Anel de síntese A
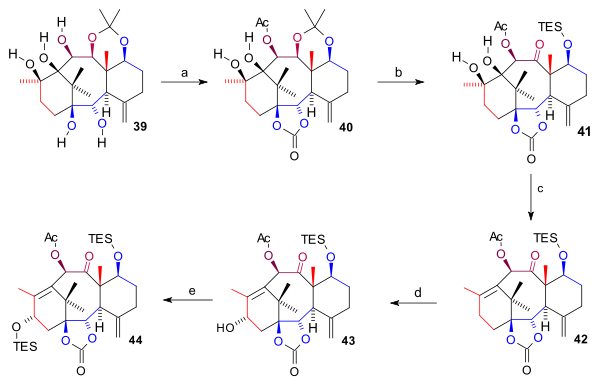
A síntese do anel A ( esquema 4 ) começou com a redução do grupo cetona C9 em 28 para diol 29 com alano em tolueno seguido por proteção de diol em 30 como um carbonato de dimetila . Isso permitiu a oxidação seletiva do álcool C1 com DDQ após a desproteção em cetona 31 . Este composto foi alquilado em 32 no grupo C1 cetona com o brometo de Grignard homoalil magnésio (fragmento C4 completando a estrutura de carbono) e desprotegido em C11 ( TBAF ) em diol 33 . Por reação com ciclohexilmetilsilildicloreto de ambos os grupos álcool participaram de um silil éter cíclico ( 34 ) que foi novamente clivado por reação com metil lítio expondo o álcool C11 em 35 . O fechamento do anel A exigiu dois grupos cetona para um acoplamento de pinacol que foi realizado por oxidação do álcool C11 (TPAP, NMO) em cetona 36 e oxidação Wacker do grupo alil em dicetona 37 . Após a formação do produto pinacol 38, os grupos benzil ( sódio , amônia ) e os grupos trialquilsilil (TBAF) foram removidos para formar o pentaol 39 .
| Esquema 4 |
|---|
O pentaol 39 foi protegido duas vezes: dois grupos hidroxila inferiores como um éster carbonato (bis (triclorometil) carbonato, piridina ) e o grupo hidroxila C10 como o acetato que forma 40 . O grupo acetonido foi removido (HCl, THF), o grupo hidroxila C7 protegido como um éter silílico TES e o grupo C11 OH oxidado (TPAP, NMO) na cetona 41 . O grupo diol do anel A foi removido em seguida em uma reação de eliminação combinada e desoxigenação de Barton com 1,1'-tiocarbonildiimidazol formando alceno 42 . Finalmente, o grupo hidroxila C15 foi introduzido por oxidação na posição alila com em duas etapas PPC e acetato de sódio (para a enona ) e com K-selectride para o álcool 43 que foi protegido como um éter TES em 44 .
| Esquema 5 |
|---|
Anel D de Síntese
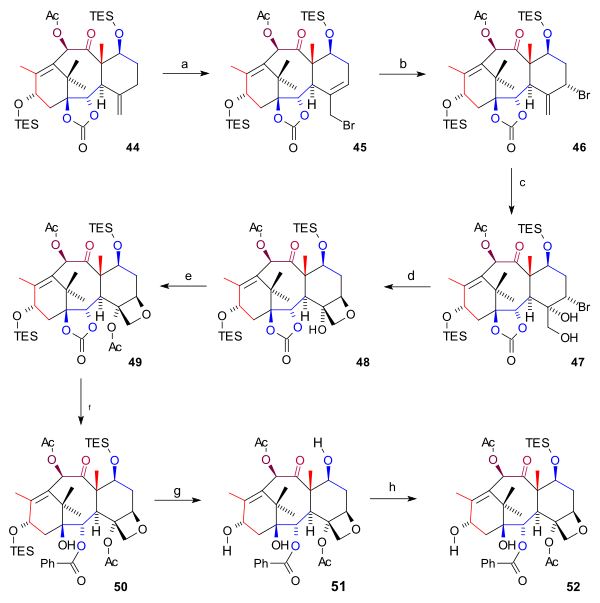
A síntese do anel D ( esquema 6 ) iniciado a partir de 44 com alílico bromação com cobre (I), brometo e benzoílo terc-butil peróxido de brometo 45 . Ao adicionar ainda mais brometo, outro brometo 46 se formou (ambos os compostos estão em equilíbrio químico ) com o átomo de bromo em uma posição axial . O tetróxido de ósmio adicionou dois grupos hidroxila à ligação dupla exocíclica no diol 47 e o fechamento do anel oxetano no 48 ocorreu com DBU em uma substituição nucleofílica . Em seguida, a acilação do grupo hidroxila C4 ( anidrido acético , DMAP , piridina ) resultou em acetato 49 . Nas etapas finais, o fenilítio abriu o grupo éster para formar hidroxicarbonato 50 , ambos os grupos TES foram removidos ( HF , pir ) para triol 51 (bacatina III) e o grupo hidroxil C7 foi protegido de volta para 52 .
| Esquema 6 |
|---|
Síntese de cauda
A síntese da cauda de amida ( esquema 7 ) foi baseada em uma reação Aldol assimétrica . O composto de partida é o disponível comercialmente ácido benziloxiac�tico 53 que foi convertido para o tio éster 55 ( etanotiol ) através do cloreto de ácido 54 ( cloreto de tionilo , piridina ). Este formou o éter sililenol 55 ( n- butil-lítio , cloreto de trimetilsilil , Diisopropilamina ) que reagiu com o catalisador amina quiral 58 , triflato de estanho e nBu 2 (OAc) 2 em uma adição de aldol de Mukaiyama com benzaldeído ao álcool 59 com 99% de anti-seletividade e 96% ee . A próxima etapa de conversão do grupo álcool em uma amina em 60 foi uma reação de Mitsunobu ( azida de hidrogênio , azodicarboxilato de dietila , trifenilfosfina com redução de azida em amina por Ph 3 P). O grupo amina foi benzoilado com cloreto de benzoil ( 61 ) e a hidrólise remove o grupo tioéter em 62 .
| Esquema 7 |
|---|
Adição de cauda
Nas etapas sintéticas finais ( esquema 8 ), a cauda de amida 62 foi adicionada ao anel ABCD 52 em uma esterificação catalisada por o, o'-di (2-piridil) tiocarbonato (DPTC) e DMAP formando éster 63 . O grupo de proteção Bn foi removido por hidrogenação usando hidróxido de paládio sobre carbono ( 64 ) e, finalmente, o grupo TES foi removido por HF e piridina para produzir Taxol 65 .
| Esquema 8 |
|---|
Veja também
- Síntese total de Danishefsky Taxol
- Síntese total de Holton Taxol
- Síntese total de Kuwajima Taxol
- Síntese total de Nicolaou Taxol
- Síntese total de paclitaxel
- Síntese total de Wender Taxol
Referências
- Bibliografia
- Mukaiyama, Teruaki (1999). "Síntese total assimétrica de taxol Teruaki Mukaiyama, Isamu Shiina, Hayato Iwadare, Masahiro Saitoh, Toshihiro Nishimura, Naoto Ohkawa, Hiroki Sakoh, Koji Nishimura, Yu-ichirou Tani, Masatoshi Hasegawa, Kojiuki Saitoh, Katsuyh Chem. EUR. J. 5 (1): 121–161. doi : 10.1002 / (SICI) 1521-3765 (19990104) 5: 1 <121 :: AID-CHEM121> 3.0.CO; 2-O .
- Citações