Síndrome de Smith-Lemli-Opitz - Smith–Lemli–Opitz syndrome
| Síndrome de Smith – Lemli – Opitz | |
|---|---|
| Outros nomes | SLOS , ou deficiência de 7-desidrocolesterol redutase |
 | |
| 7-desidrocolesterol é um metabólito esteroidal tóxico que se acumula nos corpos de pessoas com SLOS | |
| Especialidade |
Genética Médica |
| Início usual | Presente no nascimento |
| Frequência | 1 em 20.000 a 1 em 60.000 |
A síndrome de Smith-Lemli-Opitz é um erro inato da síntese do colesterol. É uma síndrome de malformação múltipla autossômica recessiva , causada por uma mutação na enzima 7-desidrocolesterol redutase codificada pelo gene DHCR7. Causa um amplo espectro de efeitos, desde deficiência intelectual leve e problemas comportamentais a malformações letais.
sinais e sintomas
SLOS pode se apresentar de forma diferente em casos diferentes, dependendo da gravidade da mutação e outros fatores. Originalmente, os pacientes com SLOS foram classificados em duas categorias (clássico e grave) com base nas características físicas e mentais, ao lado de outras características clínicas. Desde a descoberta do defeito bioquímico específico responsável pela SLOS, os pacientes recebem uma pontuação de gravidade com base em seus níveis de defeitos cerebrais, oculares, orais e genitais. Em seguida, é usado para classificar os pacientes como portadores de SLOS leve, clássica ou grave.
Características físicas
As características faciais mais comuns de SLOS incluem microcefalia , estreitamento bitemporal (distância reduzida entre as têmporas), ptose , nariz curto e arrebitado, micrognatia , pregas epicânticas e hemangioma capilar do nariz. Outras características físicas incluem:
- orelhas inseridas baixas e giradas posteriormente
- palato duro, estreito e arqueado alto
- fenda lábio / palato
- agenesia ou hipoplasia do corpo caloso
- hipoplasia cerebelar
- tamanho ventricular aumentado
- tamanho diminuído do lobo frontal
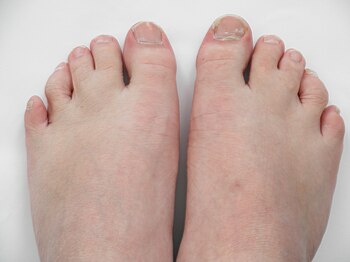
- polidactilia de mãos ou pés
- polegar curto colocado proximalmente
- outras malformações de dedo
- sindactilia do segundo e terceiro dedos do pé
- genitália masculina ambígua ou feminina
- defeitos cardíacos congênitos
- anormalidades renais, pulmonares, hepáticas e oculares
Características comportamentais
Certos comportamentos e atributos são comumente vistos entre pacientes que sofrem de SLOS. Eles podem ter baixa inteligência normal e reagir negativamente ou com hipersensibilidade a diferentes estímulos sensoriais. Isso é particularmente verdadeiro para certos estímulos auditivos e visuais. Muitos pacientes mostram agressividade e comportamentos autolesivos , e distúrbios do sono são comuns. Comportamentos específicos semelhantes aos de pessoas com autismo estão frequentemente presentes, bem como hiperatividade , o que fornece insights genéticos e biológicos sobre os transtornos do espectro do autismo. Os comportamentos autistas mais característicos de pacientes com SLOS são opistocinesia (um movimento da parte superior do corpo), alongamento da parte superior do corpo e sacudidelas das mãos. O autismo é tipicamente diagnosticado separadamente do SLOS usando o DSM-V , e aproximadamente 50–75% dos pacientes com SLOS atendem aos critérios para autismo.
Outros comportamentos associados a SLOS podem estar diretamente ligados a anormalidades físicas. Por exemplo, bebês geralmente apresentam problemas de alimentação ou intolerância alimentar, e os pacientes podem necessitar de ingestão calórica aumentada devido ao metabolismo acelerado. Infecções recorrentes, incluindo infecções de ouvido e pneumonia, também são comuns.
Fenótipo bioquímico
Dado que SLOS é causado por uma mutação em uma enzima envolvida na síntese de colesterol, as características bioquímicas resultantes podem ser previsíveis. A maioria dos pacientes apresenta níveis reduzidos de colesterol plasmático ( hipocolesterolemia ). No entanto, aproximadamente 10% podem apresentar níveis normais de colesterol, e as concentrações diminuídas de colesterol não são apenas indicativas de SLOS. Níveis aumentados de precursores de colesterol também são comuns em SLOS. Em particular, níveis elevados de 7-desidrocolesterol são bastante específicos para SLOS.
Genética
DHCR7
O gene que codifica DHCR7 (rotulado como DHCR7 ) foi clonado em 1998 e foi mapeado para o cromossomo 11q12-13 . Tem 14100 pares de bases de comprimento e nove exões , o mRNA correspondente tem 2786 pares de bases de comprimento (a sequência de DNA restante é intrônica). A estrutura do gene DHCR7 do rato é muito semelhante à estrutura do gene humano.
Os níveis mais elevados de expressão de DHCR7 foram detectados na glândula adrenal, testículos, fígado e tecido cerebral. A sua expressão é induzida por diminuição de esterol concentrações através de proteínas de ligação de regulação de esterol (SREBP). Também há evidências de que sua atividade pode ser regulada por transcrição específica de tecido e splicing alternativo .
Conforme descrito acima, a enzima DHCR7 catalisa a redução de 7DHC em colesterol, bem como a redução de 7-desidrodesmosterol em desmosterol. Requer o NADPH como co-fator para essa redução e pode envolver a atividade da oxidorredutase do citocromo P450 . Acredita-se que também contenha ferro. DHCR7 é uma proteína de membrana integral do retículo endoplasmático e modelos de computador previram até nove domínios transmembrana . DHCR7 é mais eficiente na redução de 7DHC, mas é conhecido por reduzir a ligação dupla do carbono 7 de outros esteróis, indicando uma faixa de especificidade de substrato . Prevê-se que a versão humana desta enzima tenha um peso molecular de 54.489 kDa e um ponto isoelétrico de 9,05.
O amino ácido de sequência que codifica DHCR7 está previsto para conter 475 amino ácidos, bem como vários motivos proteicos . Ele contém vários motivos da esterol redutase, como seria de se esperar dada sua função. Ele contém um domínio potencial de detecção de esterol (SSD), cuja função é desconhecida, mas considerada necessária para a ligação de substratos de esterol. Também inclui vários locais de fosforilação, incluindo potenciais locais de proteína quinase C e tirosina quinase (enzimas regulatórias responsáveis pela fosforilação). A função exata de fosforilar DHCR7 ainda é desconhecida, mas acredita-se que esteja envolvida na regulação de sua atividade.
Mutações e incidência
SLOS é uma doença autossômica recessiva . Mais de 130 tipos diferentes de mutações foram identificados. Mutações missense (alteração de um único nucleotídeo resultando em um código para um aminoácido diferente) são as mais comuns, respondendo por 87,6% do espectro SLOS. Normalmente, eles reduzem a função da enzima, mas podem não inibi-la completamente. Muito depende da natureza da mutação (ou seja, qual aminoácido é substituído e onde). Mutações nulas são muito menos comuns, essas mutações produzem uma enzima completamente disfuncional ou nenhuma enzima. Assim, mutações sem sentido podem ser mais comuns em geral porque são menos letais do que mutações sem sentido; mutações sem sentido podem simplesmente resultar em aborto espontâneo .
O IVS8-1G> C é a mutação relatada com mais frequência no DHCR7 . Isso interrompe a união dos exons oito e nove e resulta na inserção de 134 nucleotídeos na transcrição DHCR7 . Essa é uma mutação sem sentido, portanto, os pacientes homozigotos para esse alelo são gravemente afetados. Pensa-se que esta mutação ocorreu pela primeira vez nas Ilhas Britânicas , e tem uma frequência de portadores (aqueles que são heterozigotos para o alelo, mas não afetados) de 1,09% para caucasianos de herança europeia. A frequência das mutações difere para várias etnias, dependendo da origem da mutação. Em todas as populações caucasianas, esta mutação em particular tem uma frequência de portadores estimada de 3%.
A próxima mutação mais comum é 278C> T e resulta em uma treonina na posição do aminoácido 93. É uma mutação missense e tende a estar associada a sintomas menos graves. Essa mutação é a mais comum observada em pacientes de ascendência italiana, cubana e mediterrânea.
A terceira mutação mais comum é 452G> A. Esta mutação sem sentido causa a terminação da proteína, de modo que a enzima DHCR7 não seria formada. Pensa-se que surgiu no sul da Polónia e é mais comum no norte da Europa.
Outras mutações são menos comuns, embora pareçam ter como alvo certos domínios de proteínas mais do que outros. Por exemplo, os motivos da esterol redutase são locais comuns de mutação. No geral, há uma frequência de portadora estimada (para qualquer mutação DHCR7 causando SLOS) de 3-4% nas populações caucasianas (é menos frequente entre as populações asiáticas e africanas). Este número indica uma incidência hipotética de nascimentos entre 1/2500 e 1/4500. No entanto, a incidência medida está entre 1 / 10.000 a 1 / 60.000 (difere dependendo da herança e descendência). Isso é muito menor do que o esperado. Isso indica que muitos casos de SLOS não são detectados e provavelmente se devem ao aborto espontâneo causado por mutações graves (aborto espontâneo) ou a casos leves não diagnosticados. As mulheres não têm as malformações genitais características que os homens afetados têm e, portanto, têm menos probabilidade de serem diagnosticadas corretamente.
Metabolismo e função do colesterol
Metabolismo
O colesterol pode ser obtido por meio da dieta, mas também pode ser formado pelo metabolismo do corpo. O metabolismo do colesterol ocorre principalmente no fígado, com quantidades significativas também no intestino. Também deve ser observado que o colesterol não pode passar pela barreira hematoencefálica , portanto, dentro do cérebro, a biossíntese é a única fonte de colesterol.
Em humanos, a síntese do colesterol começa com a via do mevalonato (ver diagrama), levando à síntese do farnesil pirofosfato (FPP). Esta via usa dois acetil-CoA e dois NADPH para fazer mevalonato , que é metabolizado em isopentenil pirofosfato (IPP) usando três ATP . A partir daí, três IPP são necessários para fazer um FPP. A combinação de dois FPP leva à formação de esqualeno ; isso representa o primeiro passo comprometido para a biossíntese do colesterol. O esqualeno leva à criação de lanosterol , a partir do qual existem várias vias que levam à biossíntese do colesterol. A etapa limitante da taxa de síntese do colesterol é a conversão de 3-hidroxi-3-metilglutaril-CoA (HMG-CoA) em mevalonato, esta é uma etapa inicial na via do mevalonato catalisada pela HMG-CoA redutase .
Por meio de uma série de reações complicadas, o lanosterol leva à formação de zimosterol . Conforme mostrado em um diagrama à direita, é neste ponto que o caminho diverge. Em humanos, a principal via que leva ao colesterol é conhecida como via Kandutsch-Russell. O zimosterol é metabolizado em 5α-colesta-7,24-dien-3β-ol, depois em lathosterol e, em seguida, em 7-desidrocolesterol ou 7-DHC. O 7-DHC é o precursor imediato do colesterol e a enzima DHCR7 é responsável por converter o 7-DHC em colesterol. DHCR7 reduz a ligação dupla no carbono 7 de 7-DHC, levando ao produto não esterificado . Mutações nesta enzima são responsáveis por uma ampla gama de defeitos presentes na SLOS. Em outra via que leva à síntese de colesterol, DHCR7 é necessário para a redução de 7-desidrodesmosterol a desmosterol .
Regulamento
A regulação da síntese do colesterol é complexa e ocorre principalmente por meio da enzima HMG-CoA redutase (catalisador da etapa de limitação da taxa). Envolve um ciclo de feedback que é sensível aos níveis celulares de colesterol. As quatro etapas principais de regulação são:
- A síntese da enzima HMG-CoA redutase é controlada pela proteína de ligação do elemento regulador de esterol (SREBP). Este é um fator de transcrição que é inativo quando os níveis de colesterol estão altos e ativo quando os níveis de colesterol estão baixos. Quando os níveis de colesterol caem, o SREBP é liberado da membrana nuclear ou retículo endoplasmático , então migra para o núcleo e causa a transcrição do gene da HMG-CoA redutase .
- A tradução (criando a enzima a partir do transcrito do mRNA) da HMG-CoA redutase é inibida por derivados de mevalonato e pelo colesterol da dieta.
- A degradação da HMG-CoA redutase é rigidamente controlada. A parte da enzima que está ligada ao retículo endoplasmático detecta sinais, como níveis elevados de colesterol, que levam à sua degradação ou proteólise .
- Quando a HMG-CoA redutase é fosforilada , sua atividade diminui. Isso significa que a síntese de colesterol é reduzida quando os níveis de energia celular (ATP) estão baixos.
Função
O colesterol é um lipídio importante envolvido no metabolismo, função celular e estrutura. É um componente estrutural da membrana celular , de modo que fornece estrutura e regula a fluidez da bicamada fosfolipídica . Além disso, o colesterol é um constituinte das jangadas lipídicas . Estas são congregações de proteínas e lipídios (incluindo esfingolipídios e colesterol) que flutuam dentro da membrana celular e desempenham um papel na regulação da função da membrana. As jangadas lipídicas são mais ordenadas ou rígidas do que a bicamada da membrana que as envolve. Seu envolvimento na regulação decorre principalmente de sua associação com proteínas; após a ligação de substratos, algumas proteínas têm uma afinidade mais alta para se ligarem a jangadas de lipídios. Isso os aproxima de outras proteínas, permitindo que afetem as vias de sinalização . O colesterol atua especificamente como um espaçador e uma cola para jangadas de lipídios; a ausência de colesterol leva à dissociação de proteínas.
Dada a sua prevalência nas membranas celulares, o colesterol está altamente envolvido em certos processos de transporte . Pode influenciar a função dos canais iônicos e outros transportadores de membrana. Por exemplo, o colesterol é necessário para a atividade de ligação ao ligante do receptor da serotonina . Além disso, parece ser muito importante na exocitose . O colesterol modula as propriedades da membrana (como a curvatura da membrana) e pode regular a fusão das vesículas com a membrana celular. Também pode facilitar o recrutamento de complexos necessários para a exocitose. Dado que os neurônios dependem fortemente da exocitose para a transmissão de impulsos , o colesterol é uma parte muito importante do sistema nervoso .
Uma via particularmente relevante em que ocorre o colesterol é a via de sinalização Hedgehog . Essa via é muito importante durante o desenvolvimento embrionário e está envolvida na decisão do destino das células (ou seja, para qual tecido elas precisam migrar). As proteínas hedgehog também estão envolvidas na transcrição de genes que regulam a proliferação e diferenciação celular . O colesterol é importante para essa via porque sofre ligação covalente às proteínas Hedgehog, resultando em sua ativação. Sem colesterol, a atividade de sinalização é interrompida e a diferenciação celular pode ser prejudicada.
O colesterol é um precursor de muitas moléculas importantes. Estes incluem ácidos biliares (importantes no processamento de gorduras dietéticas), oxisteróis , neuroesteróides (envolvidos na neurotransmissão e excitação), glicocorticóides (envolvidos em processos imunológicos e inflamatórios), mineralocorticóides (equilíbrio osmótico) e esteróides sexuais (ou seja, estrogênio e testosterona ; ampla gama de função, mas envolvida no desenvolvimento genital pré-natal). Finalmente, o colesterol é o principal componente da mielina , uma camada protetora em torno dos neurônios. A mielinização ocorre mais rapidamente durante o desenvolvimento pré-natal, o que significa que a demanda pela biossíntese do colesterol é muito alta.
Patogênese
Dado que a função do colesterol abrange uma gama muito ampla, é improvável que os sintomas de SLOS sejam devidos a um único mecanismo molecular. Alguns dos efeitos moleculares ainda são desconhecidos, mas podem ser extrapolados com base no papel do colesterol. Em geral, os efeitos negativos são devidos à diminuição dos níveis de colesterol e ao aumento dos precursores do colesterol - mais notavelmente, 7DHC . Embora o 7DHC seja estruturalmente semelhante ao colesterol e possa potencialmente atuar como um substituto, os efeitos deste ainda estão sendo estudados.
A maioria dos pacientes com SLOS apresenta níveis diminuídos de colesterol, particularmente no cérebro (onde os níveis de colesterol dependem principalmente de uma nova síntese). Isso também significa que quaisquer derivados de esterol do colesterol também teriam concentrações reduzidas. Por exemplo, níveis reduzidos de neuroesteróides podem ser vistos em SLOS. Esses são lipídios que participam da sinalização dentro do cérebro e devem ser produzidos dentro do próprio cérebro. Eles são responsáveis pela interação com os receptores de esteróides nucleares e se ligam aos canais iônicos ativados por neurotransmissores . Especificamente, eles modulam os efeitos dos receptores GABA e NMDA , resultando em efeitos calmantes, melhora da memória e muito mais. Assim, como algumas características da SLOS são opostas a esses efeitos (hiperatividade, ansiedade), uma redução dos neuroesteroides poderia influenciar tanto o desenvolvimento neurológico quanto o comportamento.
Além disso, conforme descrito acima, o colesterol é um aspecto importante na sinalização de Hedgehog. Com níveis mais baixos de colesterol, as proteínas hedgehog não sofreriam a modificação covalente necessária e subsequente ativação. Isso resultaria em comprometimento do desenvolvimento embrionário e pode contribuir para os defeitos físicos congênitos observados em SLOS. Uma proteína sinalizadora de hedgehog em particular, o hedgehog sônico (SHH), é importante no padrão do sistema nervoso central, características faciais e membros. Outras proteínas hedgehog podem estar envolvidas no desenvolvimento do trato genital e do esqueleto.
Os níveis alterados de esterol em SLOS são particularmente relevantes para as membranas celulares, que são feitas principalmente de lipídios. Os pacientes com SLOS podem apresentar membranas celulares com propriedades ou composição anormais, e os níveis reduzidos de colesterol afetam muito a estabilidade e as proteínas das jangadas lipídicas . Apesar de sua semelhança estrutural, o 7DHC é incapaz de substituir o colesterol em jangadas de lipídios. Além disso, a falta de colesterol contribui para o aumento da fluidez da membrana celular e pode causar secreções de grânulos anormais . Todas essas mudanças na membrana provavelmente contribuem para mudanças nas funções de transporte que são observadas em SLOS. Eles podem causar defeitos na degranulação de mastócitos mediada por receptor de IgE e na produção de citocinas , que são células envolvidas em respostas alérgicas e imunológicas. O receptor NMDA é afetado, bem como a capacidade de ligação do receptor de serotonina do hipocampo . A interação célula a célula , que é muito importante no desenvolvimento, pode ser prejudicada. Foi demonstrado que a exocitose nas vesículas sinápticas está reduzida, provavelmente devido à fusão prejudicada da vesícula à membrana celular ou à reciclagem deficiente das vesículas. Finalmente, o colesterol é altamente prevalente na mielina , portanto, os pacientes com SLOS apresentam redução da mielinização dos hemisférios cerebrais , nervos periféricos e nervos cranianos .
Além dos níveis reduzidos de colesterol, muitos dos sintomas mostrados no SLOS resultam dos efeitos tóxicos do 7DHC. O 7DHC é conhecido por prejudicar o transporte intracelular de colesterol. Também aumenta a degradação da HMG-CoA redutase (a enzima que catalisa a etapa de limitação da taxa na síntese do colesterol). 7DHC leva-se a novos oxisterol e esteróides derivados, e muitas das suas funções ou efeitos são ainda desconhecidos. Um achado muito importante com relação ao 7DHC é que ele é o lipídio mais reativo para a peroxidação lipídica e resulta em estresse oxidativo sistêmico . A peroxidação lipídica é conhecida por destruir as membranas das células e das organelas ligadas à membrana . O derivado de 7DHC que é usado para indicar estresse oxidativo é 3β, 5α-dihidroxi-colest-7-en-6-ona (DHCEO); é formado a partir de um produto primário da peroxidação 7DHC, 7-DHC-5α, 6α-epóxido. O DHCEO é tóxico para as células neuronais e gliais corticais e acelera sua diferenciação e arborização . Por meio do estresse oxidativo, acredita-se que o 7DHC seja responsável pelo aumento da fotossensibilidade mostrado em pacientes com SLOS. A exposição normal aos raios UVA pode causar estresse oxidativo nas células da pele. Dado que o 7DHC é mais facilmente oxidado, ele aumenta os efeitos do UVA, levando ao aumento da oxidação dos lipídios da membrana e ao aumento da produção de espécies reativas de oxigênio (ROS).
Normalmente, níveis mais alterados de 7DHC e colesterol levam a sintomas mais graves de SLOS. Os níveis desses metabólitos também correspondem à gravidade da mutação (nonsense versus missense); algumas mutações de DHCR7 podem ainda mostrar a síntese de colesterol residual e outras não. No entanto, mesmo indivíduos com as mesmas mutações ou genótipo ainda podem apresentar variabilidade em seus sintomas. Isso pode ser devido a fatores maternos, como a transferência de colesterol para o feto durante a gravidez, bem como a quantidade de colesterol presente no cérebro antes da formação da barreira hematoencefálica no período pré-natal. A taxa de acúmulo e excreção de metabólitos tóxicos pode variar de pessoa para pessoa. A apolipoproteína E materna também foi implicada na variabilidade individual em SLOS, embora a natureza exata dessa relação seja desconhecida. Provavelmente, existem mais fatores que contribuem para o amplo espectro de efeitos em SLOS que ainda não foram descobertos.
Triagem e diagnóstico
Pré-natal
O indicador bioquímico mais característico de SLOS é uma concentração aumentada de 7DHC ( níveis reduzidos de colesterol também são típicos, mas aparecem em outros distúrbios também). Assim, no pré-natal , SLOS é diagnosticado ao encontrar uma elevada razão 7DHC: esterol total em tecidos fetais, ou níveis aumentados de 7DHC no líquido amniótico . A proporção 7DHC: esterol total pode ser medida em 11-12 semanas de gestação por biópsia de vilosidade coriônica , e 7DHC elevado no líquido amniótico pode ser medido em 13 semanas. Além disso, se as mutações parentais forem conhecidas, o teste de DNA de amostras de líquido amniótico ou vilosidades coriônicas pode ser realizado.
A amniocentese (processo de coleta de líquido amniótico) e a coleta de vilosidade coriônica não podem ser realizadas até aproximadamente 3 meses de gravidez. Visto que SLOS é uma síndrome muito grave, os pais podem decidir interromper a gravidez se o feto for afetado. A amniocentese e a biópsia de vilo corial deixam muito pouco tempo para tomar essa decisão (os abortos se tornam mais difíceis com o avanço da gravidez) e também podem representar riscos graves para a mãe e o bebê. Portanto, há um desejo muito grande de testes diagnósticos não invasivos durante a gestação. Examinar as concentrações de esteróis na urina materna é uma forma potencial de identificar SLOS no pré-natal. Durante a gravidez, o feto é o único responsável por sintetizar o colesterol necessário para a produção de estriol . Um feto com SLOS não pode produzir colesterol e pode usar 7DHC ou 8DHC como precursores do estriol. Isso cria 7 ou 8-desidroestriol (como o 7-desidroestriol), que pode aparecer na urina materna. Estes são novos metabólitos devido à presença de uma ligação dupla normalmente reduzida no carbono 7 (causada pela inatividade de DHCR7) e podem ser usados como indicadores de SLOS. Outros derivados do colesterol que possuem uma ligação dupla na 7ª ou 8ª posição e estão presentes na urina materna também podem ser indicadores de SLOS. Foi demonstrado que 7 e 8-desidropreganotrióis estão presentes na urina de mães com feto afetado, mas não com feto não afetado, e, portanto, são usados no diagnóstico. Esses pregnadienos se originaram no feto e viajaram pela placenta antes de chegar à mãe. Sua excreção indica que nem a placenta nem os órgãos maternos possuem as enzimas necessárias para reduzir a dupla ligação desses novos metabólitos.
Pós-natal
Se SLOS não for detectado até depois do nascimento, o diagnóstico pode ser baseado nas características físicas, bem como encontrar níveis plasmáticos aumentados de 7DHC .
Existem muitas maneiras diferentes de detectar os níveis de 7DHC no plasma sanguíneo, uma delas é usando o reagente Liebermann-Burchard (LB) . Este é um ensaio colorimétrico simples desenvolvido com a intenção de uso para triagem em larga escala. Quando tratadas com o reagente LB, as amostras SLOS ficam rosa imediatamente e gradualmente tornam-se azuis; amostras de sangue normais são inicialmente incolores e desenvolvem uma leve cor azul. Embora esse método tenha limitações e não seja usado para fornecer um diagnóstico definitivo, ele é atraente por ser um método muito mais rápido do que o uso de culturas de células.
Outra forma de detectar o 7DHC é por meio da cromatografia gasosa , técnica usada para separar e analisar compostos. A cromatografia gasosa / espectrometria de massa de monitoramento iônico selecionado (SIM-GC / MS) é uma versão muito sensível da cromatografia gasosa e permite a detecção até de casos leves de SLOS. Outros métodos incluem espectrometria de massa de tempo de voo , feixe de partículas LC / MS, eletrospray tandem MS e absorvância ultravioleta , todos os quais podem ser usados em amostras de sangue, líquido amniótico ou vilo coriônico. Medir os níveis de ácidos biliares na urina do paciente ou estudar a atividade do DCHR7 em cultura de tecidos também são técnicas comuns de diagnóstico pós-natal.
Tratamento
O manejo de indivíduos com SLOS é complexo e geralmente requer uma equipe de especialistas. Algumas das malformações congênitas (fenda palatina) podem ser corrigidas com cirurgia. Outros tratamentos ainda não tiveram sucesso comprovado em estudos randomizados; no entanto, anedoticamente, eles parecem causar melhorias.
Suplementação de colesterol
Atualmente, a forma mais comum de tratamento para SLOS envolve a suplementação de colesterol na dieta . Relatórios anedóticos indicam que isso tem alguns benefícios; pode resultar em maior crescimento, menor irritabilidade , melhor sociabilidade, menos comportamento autolesivo , menos defesa tátil , menos infecções , mais tônus muscular, menos fotossensibilidade e menos comportamentos autistas . A suplementação de colesterol começa com uma dose de 40–50 mg / kg / dia, aumentando conforme a necessidade. É administrado através do consumo de alimentos com alto teor de colesterol (ovos, creme, fígado) ou como colesterol purificado de qualidade alimentar. Crianças mais novas e bebês podem necessitar de alimentação por sonda. No entanto, o colesterol dietético não reduz os níveis de 7DHC, não pode cruzar a barreira hematoencefálica e não parece melhorar os resultados de desenvolvimento. Um estudo empírico descobriu que a suplementação de colesterol não melhorou o atraso no desenvolvimento , independentemente da idade em que começou. Provavelmente, isso ocorre porque a maioria dos atrasos no desenvolvimento se origina de malformações do cérebro, que o colesterol da dieta não pode melhorar devido à sua incapacidade de cruzar a barreira hematoencefálica.
Terapia de sinvastatina
HMG-CoA reductase inibidores foram examinados como tratamento para SLOS. Dado que isso catalisa a etapa de limitação da taxa na síntese do colesterol, a inibição reduziria o acúmulo de metabólitos tóxicos, como o 7DHC. A sinvastatina é um conhecido inibidor da HMG-CoA redutase e, mais importante, é capaz de atravessar a barreira hematoencefálica. Foi relatado que diminui os níveis de 7DHC , bem como aumenta os níveis de colesterol . O aumento dos níveis de colesterol deve-se ao efeito da sinvastatina na expressão de diferentes genes. A sinvastatina aumenta a expressão de DHCR7 , provavelmente levando ao aumento da atividade de DHCR7. Também foi demonstrado que aumenta a expressão de outros genes envolvidos na síntese e absorção do colesterol. No entanto, esses benefícios dependem da quantidade de síntese de colesterol residual. Como alguns indivíduos possuem mutações menos graves e demonstram alguma atividade do DCHR7, essas pessoas se beneficiam mais com a terapia com sinvastatina, pois ainda têm uma enzima parcialmente funcionando. Para indivíduos que não apresentam atividade residual de DCHR7, como os homozigotos para alelos nulos ou mutações, a terapia com sinvastatina pode, na verdade, ser tóxica. Isso destaca a importância de identificar o genótipo específico do paciente com SLOS antes de administrar o tratamento. Ainda não se sabe se a sinvastatina vai melhorar os déficits comportamentais ou de aprendizagem em SLOS.
Suplementação antioxidante
Os antioxidantes são aqueles que inibem a oxidação de moléculas ou reduzem os metabólitos previamente oxidados. Dado que se pensa que alguns sintomas de SLOS resultam da peroxidação de 7DHC e seus derivados, a inibição desta peroxidação provavelmente teria efeitos benéficos. Foi demonstrado que os antioxidantes aumentam o nível de transcritos lipídicos em células SLOS, esses transcritos desempenham um papel na biossíntese de lipídeos (colesterol) e são conhecidos por serem regulados negativamente em SLOS. Além disso, a vitamina E é especificamente conhecida por diminuir os níveis de DHCEO, que é um indicador de estresse oxidativo em SLOS, além de apresentar alterações benéficas na expressão gênica. A vitamina E parece ser o antioxidante mais poderoso para o tratamento de SLOS e, em modelos de ratos, reduziu os níveis de oxisteróis no cérebro. No entanto, os antioxidantes só foram estudados em modelos animais de SLOS ou células SLOS isoladas. Assim, seu significado clínico e efeitos colaterais negativos ainda são desconhecidos, e seu uso ainda não foi estudado em humanos.
Outras considerações
Ao tratar SLOS, um problema recorrente é se os déficits intelectuais e comportamentais são ou não devido a problemas fixos de desenvolvimento (ou seja, malformações cerebrais fixas), ou devido a níveis anormais de esterol em curso que interrompem a função normal do cérebro e outros tecidos. Se o último for verdadeiro, então os tratamentos que alteram os níveis e proporções de esterol, particularmente no cérebro, provavelmente irão melhorar o resultado do desenvolvimento do paciente. No entanto, se a primeira opção for verdadeira, o tratamento provavelmente ajudará apenas com os sintomas e não com déficits de desenvolvimento específicos.
Pesquisar
O animal mais comum usado para estudar SLOS é o rato . De acordo com a BioCyc , a biossíntese do colesterol em ratos é muito semelhante à dos humanos. Mais importante ainda, os camundongos possuem DHCR7 (a enzima responsável por SLOS) e HMG-CoA redutase (a etapa limitadora da taxa de síntese do colesterol. Os ratos são semelhantes aos camundongos e também têm sido usados. Existem duas maneiras populares de modelos animais de SLOS são criados. O primeiro está usando teratógenos , o segundo está usando manipulações genéticas para criar mutações no gene DHCR7 .
Modelos teratogênicos
Modelos teratogênicos são induzidos alimentando ratas grávidas ou camundongos com inibidores de DCHR7. Dois inibidores comuns são BM15766 (ácido 4- (2- [1- (4-clorocinamil) piperazin-4-il] etil) -benzóico) e AY9944 (dicloridrato de trans-l, 4-bis (2-clorobenzilaminometil) ciclohexano). Esses compostos têm propriedades químicas e físicas diferentes, mas induzem efeitos semelhantes. AY9944 mostrou induzir holoprosencefalia e malformações sexuais semelhantes às observadas em humanos com SLOS. Também é conhecido por causar deficiências no receptor de serotonina , outro defeito comumente visto em pacientes com SLOS. BM15766 produziu a falta de síntese de colesterol e ácido biliar que é observada em pacientes SLOS com mutações homozigóticas . Todos os modelos teratogênicos podem ser usados efetivamente para estudar SLOS; no entanto, apresentam níveis mais baixos de 7-DHC e 8-DHC do que em humanos. Isso pode ser explicado pelo fato de que os humanos experimentam um bloqueio permanente em sua atividade DHCR7, enquanto camundongos e ratos tratados com inibidores experimentam apenas bloqueios transitórios. Além disso, diferentes espécies de camundongos e ratos são mais resistentes a teratógenos e podem ser menos eficazes como modelos de SLOS. Os modelos teratogênicos são mais comumente usados para estudar mais os efeitos de longo prazo da SLOS, porque eles sobrevivem mais do que os modelos genéticos. Por exemplo, um estudo examinou a degeneração retinal de SLOS, que em ratos não ocorre até pelo menos um mês após o nascimento.
Modelos genéticos
Os modelos genéticos de SLOS são criados eliminando o gene DHCR7 . Um estudo usou recombinação homóloga para interromper DCHR7 em células-tronco embrionárias de camundongo . Semelhante ao que é encontrado em humanos, camundongos heterozigotos (tendo apenas um alelo mutado) eram fentoipicamente normais e foram cruzados para produzir filhotes (camundongos jovens) homozigotos para o alelo mutado. Embora esses filhotes tenham morrido no primeiro dia de vida devido à incapacidade de se alimentar, eles apresentavam características semelhantes aos humanos com SLOS. Eles tinham níveis diminuídos de colesterol, níveis aumentados de 7- e 8DHC, apresentaram menor crescimento e menor peso ao nascer, malformações craniofaciais e menos movimentos. Muitos também apresentavam fenda palatina e diminuição das respostas neuronais ao glutamato . No geral, entretanto, os filhotes tinham menos características dismórficas do que pacientes humanos com SLOS; não apresentavam malformações de membros, renais, adrenais ou do sistema nervoso central . Isso se explica pelo fato de que, nos roedores, o colesterol materno pode atravessar a placenta e, na verdade, parece ser essencial para o desenvolvimento do feto. Em humanos, muito pouco colesterol materno é transferido para o feto. Em suma, o modelo genético de camundongo é útil para explicar a neuropatofisiologia da SLOS.
Descobertas
Muitas descobertas na pesquisa SLOS foram feitas usando modelos animais. Eles têm sido usados para estudar diferentes técnicas de tratamento, incluindo a eficácia da terapia com sinvastatina . Outros estudos examinaram as características comportamentais ao tentar explicar sua patogênese subjacente. Um achado comum é que modelos de camundongos de SLOS mostram desenvolvimento serotonérgico anormal , que pode ser pelo menos parcialmente responsável pelos comportamentos autistas vistos em SLOS. Modelos de camundongos também têm sido usados para desenvolver técnicas de diagnóstico; vários estudos examinaram biomarcadores que resultam da oxidação de 7DHC, como o DHCEO. É provável que, à medida que os modelos animais são aprimorados, eles levem a muito mais descobertas na pesquisa de SLOS.
Eponym
Tem o nome de David Weyhe Smith (1926–1981), um pediatra americano; Luc Lemli (1935–), um médico belga; e John Marius Opitz (1935–), um médico alemão-americano. Estes são os pesquisadores que descreveram pela primeira vez os sintomas da SLOS.
Referências
![]() Este artigo incorpora material de domínio público do documento da Biblioteca Nacional de Medicina dos Estados Unidos : "Genetics Home Reference" .
Este artigo incorpora material de domínio público do documento da Biblioteca Nacional de Medicina dos Estados Unidos : "Genetics Home Reference" .
links externos
| Classificação | |
|---|---|
| Fontes externas |