Estrutura metal-orgânica - Metal–organic framework
Estruturas metal-orgânicas (MOFs) são uma classe de compostos que consistem em íons metálicos ou clusters coordenados a ligantes orgânicos para formar estruturas unidimensionais, bidimensionais ou tridimensionais. Eles são uma subclasse de polímeros de coordenação , com a característica especial de serem frequentemente porosos . Os ligandos orgânicos incluídos são por vezes referidos como "struts" ou "ligantes", sendo um exemplo o ácido 1,4-benzenodicarboxílico (BDC).
Mais formalmente, uma estrutura metal-orgânica é uma rede de coordenação com ligantes orgânicos contendo vazios potenciais. Uma rede de coordenação é um composto de coordenação que se estende, por meio de entidades de coordenação repetidas, em uma dimensão, mas com ligações cruzadas entre duas ou mais cadeias individuais, loops ou spiro-links, ou um composto de coordenação que se estende por meio de entidades de coordenação repetidas em dois ou três dimensões; e, finalmente, um polímero de coordenação é um composto de coordenação com entidades de coordenação repetidas que se estendem em uma, duas ou três dimensões.
Em alguns casos, os poros são estáveis durante a eliminação das moléculas hóspedes (geralmente solventes) e podem ser recarregados com outros compostos. Por causa dessa propriedade, os MOFs são interessantes para o armazenamento de gases como hidrogênio e dióxido de carbono . Outras aplicações possíveis dos MOFs são na purificação de gases , na separação de gases , na remediação de água , na catálise , como sólidos condutores e como supercapacitores .
A síntese e as propriedades dos MOFs constituem o foco principal da disciplina chamada química reticular (do latim retículo , "pequena rede"). Em contraste com MOFs, estruturas orgânicas covalentes (COFs) são feitas inteiramente de elementos leves (H, B, C, N e O) com estruturas estendidas.
Estrutura
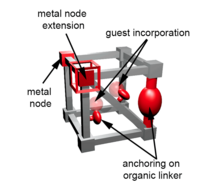
Os MOFs são compostos de dois componentes principais: um íon metálico ou grupo de íons metálicos e uma molécula orgânica chamada ligante. Por esse motivo, os materiais são freqüentemente chamados de materiais híbridos orgânico-inorgânico; no entanto, essa terminologia foi recentemente desencorajada explicitamente. As unidades orgânicas são tipicamente ligantes mono-, di-, tri- ou tetravalentes . A escolha do metal e do ligante dita a estrutura e, portanto, as propriedades do MOF. Por exemplo, a preferência de coordenação do metal influencia o tamanho e a forma dos poros, ditando quantos ligantes podem se ligar ao metal e em qual orientação.
| Dimensionalidade do Inorgânico | |||||
|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | ||
| 0 | Complexos Moleculares | Cadeias inorgânicas híbridas | Camadas inorgânicas híbridas | Híbridos inorgânicos 3-D | |
| 1 | Polímeros de coordenação de cadeia | Camadas inorgânicas-orgânicas mistas | Estrutura mista 3-D inorgânica-orgânica | ||
| 2 | Polímero de coordenação em camadas | Estrutura mista 3-D inorgânica-orgânica | |||
| 3 | Polímeros de coordenação 3-D | ||||
Para descrever e organizar as estruturas dos MOFs, um sistema de nomenclatura foi desenvolvido. As subunidades de um MOF, chamadas de unidades de construção secundárias (SBU), podem ser descritas por topologias comuns a várias estruturas. Cada topologia, também chamada de rede, recebe um símbolo, que consiste em três letras minúsculas em negrito. MOF-5 , por exemplo, tem uma rede pcu .
Ligados aos SBUs estão os ligantes de ponte . Para MOFs, ligantes de ponte típicos são ácidos di- e tricarboxílicos. Esses ligantes normalmente têm estruturas rígidas. Os exemplos são o ácido benzeno-1,4-dicarboxílico (BDC ou ácido tereftálico, ácido bifenil-4,4'-dicarboxílico (BPDC) e o ácido tricarboxílico ácido trimésico .
Síntese
Síntese geral
O estudo dos MOFs desenvolveu-se a partir da química de coordenação e da química inorgânica de estado sólido, especialmente as zeólitas . Exceto para o uso de ligantes pré-formados, MOFs e zeólitas são produzidos quase exclusivamente por técnicas hidrotérmicas ou solvotérmicas, onde os cristais crescem lentamente a partir de uma solução quente. Em contraste com os zeólitos, os MOFs são construídos a partir de ligantes orgânicos em ponte que permanecem intactos ao longo da síntese. A síntese do zeólito freqüentemente faz uso de um "modelo". Os modelos são íons que influenciam a estrutura da estrutura inorgânica em crescimento. Os íons de modelagem típicos são cátions de amônio quaternário, que são removidos posteriormente. Em MOFs, a estrutura é modelada pela SBU (unidade de construção secundária) e os ligantes orgânicos. Uma abordagem de modelagem que é útil para MOFs destinados ao armazenamento de gás é o uso de solventes de ligação a metais, como N, N-dietilformamida e água. Nestes casos, os locais de metal são expostos quando o solvente é evacuado, permitindo que o hidrogênio se ligue nesses locais.
Quatro desenvolvimentos foram particularmente importantes para o avanço da química dos MOFs. (1) O princípio geométrico de construção em que as unidades contendo metal eram mantidas em formas rígidas. Os primeiros MOFs continham átomos únicos ligados a ligantes de coordenação ditópica. A abordagem não só levou à identificação de um pequeno número de topologias preferidas que poderiam ser almejadas na síntese projetada, mas foi o ponto central para alcançar uma porosidade permanente. (2) O uso do princípio isoreticular onde o tamanho e a natureza de uma estrutura muda sem mudar sua topologia levou a MOFs com porosidade ultra-alta e aberturas de poros incomumente grandes. (3) A modificação pós-sintética de MOFs aumentou sua funcionalidade ao reagir unidades orgânicas e complexos metal-orgânicos com ligantes. (4) MOFs multifuncionais incorporaram várias funcionalidades em uma única estrutura.
Uma vez que ligantes em MOFs normalmente se ligam reversivelmente, o crescimento lento dos cristais geralmente permite que os defeitos sejam redissolvidos, resultando em um material com cristais em escala milimétrica e uma densidade de defeito próxima do equilíbrio. A síntese solvotérmica é útil para o cultivo de cristais adequados para a determinação da estrutura, porque os cristais crescem ao longo de horas a dias. No entanto, o uso de MOFs como materiais de armazenamento para produtos de consumo exige um imenso aumento de escala de sua síntese. O aumento de escala de MOFs não foi amplamente estudado, embora vários grupos tenham demonstrado que as microondas podem ser usadas para nuclear cristais de MOF rapidamente da solução. Esta técnica, denominada "síntese solvotérmica assistida por micro-ondas", é amplamente utilizada na literatura sobre zeólitos e produz cristais em escala mícron em questão de segundos a minutos, com rendimentos semelhantes aos métodos de crescimento lento.
Alguns MOFs, como o mesoporoso MIL-100 (Fe), podem ser obtidos em condições amenas à temperatura ambiente e em solventes verdes (água, etanol) por meio de métodos de síntese escalonáveis.
Uma síntese livre de solvente de uma variedade de MOFs cristalinos foi descrita. Normalmente, o acetato de metal e o proligando orgânico são misturados e triturados em um moinho de bolas. Cu 3 (BTC) 2 pode ser rapidamente sintetizado desta forma em rendimento quantitativo. No caso do Cu 3 (BTC) 2, a morfologia do produto sintetizado sem solvente era a mesma do Basolite C300 feito industrialmente. Pensa-se que a fusão localizada dos componentes devido à alta energia de colisão no moinho de bolas pode auxiliar na reação. A formação de ácido acético como subproduto nas reações no moinho de bolas também pode ajudar na reação tendo um efeito solvente no moinho de bolas. Foi demonstrado que a adição de pequenas quantidades de etanol para a síntese mecanoquímica do Cu 3 (BTC) 2 reduz significativamente a quantidade de defeitos estruturais no material obtido.
Um avanço recente na preparação sem solvente de filmes e compostos MOF é sua síntese por deposição química de vapor . Este processo, MOF-CVD, foi demonstrado pela primeira vez para ZIF-8 e consiste em duas etapas. Em uma primeira etapa, camadas precursoras de óxido metálico são depositadas. Na segunda etapa, essas camadas precursoras são expostas a moléculas ligantes sublimadas , que induzem uma transformação de fase para a rede cristalina MOF. A formação de água durante essa reação desempenha um papel crucial no direcionamento da transformação. Este processo foi ampliado com sucesso para um processo de sala limpa integrado, em conformidade com os padrões de microfabricação industrial.
Vários métodos foram relatados para o crescimento de MOFs como filmes finos orientados. No entanto, esses métodos são adequados apenas para a síntese de um pequeno número de topologias MOF. Um exemplo é a conversão assistida por vapor (VAC), que pode ser usada para a síntese de filme fino de vários MOFs do tipo UiO.
Síntese de alto rendimento
Os métodos de alto rendimento (HT) são parte da química combinatória e uma ferramenta para aumentar a eficiência. Basicamente, existem duas estratégias sintéticas dentro dos métodos HT: Por um lado, a abordagem combinatória, aqui todas as reações ocorrem em um vaso, o que leva a misturas de produtos e, por outro lado, a síntese paralela, aqui as reações ocorrem em vasos diferentes. Além disso, é feita uma distinção entre filmes finos e métodos à base de solvente.
A síntese solvotérmica pode ser realizada convencionalmente em um reator de teflon em um forno de convecção ou em reatores de vidro em um forno de micro-ondas (síntese de micro-ondas de alto rendimento). O uso de um forno de micro-ondas altera, em parte drasticamente, os parâmetros de reação.
Além da síntese solvotérmica, houve avanços no uso de fluido supercrítico como solvente em um reator de fluxo contínuo. Água supercrítica foi usada pela primeira vez em 2012 para sintetizar MOFs à base de cobre e níquel em apenas alguns segundos. Em 2020, o dióxido de carbono supercrítico foi usado em um reator de fluxo contínuo ao longo da mesma escala de tempo que o método supercrítico à base de água, mas o ponto crítico inferior de dióxido de carbono permitiu a síntese do MOF UiO-66 à base de zircônio.
Síntese solvotérmica de alto rendimento
Na síntese solvotérmica de alto rendimento, um reator solvotérmico com (por exemplo) 24 cavidades para reatores de teflon é usado. Esse reator às vezes é chamado de multiclav. O bloco do reator ou inserto do reator é feito de aço inoxidável e contém 24 câmaras de reação, que são dispostas em quatro filas. Com os reatores de teflon miniaturizados, podem ser usados volumes de até 2 mL. O bloco do reator é selado em autoclave de aço inoxidável; para isso, os reatores cheios são inseridos no fundo do reator, os reatores de teflon são selados com dois filmes de teflon e a parte superior do reator é colocada. A autoclave é então fechada em uma prensa hidráulica. O reator solvotérmico selado pode então ser submetido a um programa de temperatura-tempo. O filme de teflon reutilizável serve para resistir ao estresse mecânico, enquanto o filme de teflon descartável sela os vasos de reação. Após a reação, os produtos podem ser isolados e lavados paralelamente em um filtro a vácuo. No papel de filtro, os produtos são então apresentados separadamente em uma chamada biblioteca de amostras e podem ser posteriormente caracterizados por difração de pó de raios-X automatizada. As informações obtidas são então utilizadas para planejar outras sínteses.
Replicação pseudomórfica
Os eventos de substituição de minerais pseudomórficos ocorrem sempre que uma fase mineral entra em contato com um fluido com o qual está fora de equilíbrio. O reequilíbrio tenderá a ocorrer para reduzir a energia livre e transformar a fase inicial em uma fase mais estável termodinamicamente, envolvendo subprocessos de dissolução e reprecipitação.
Inspirado por tais processos geológicos, os filmes finos de MOF podem ser desenvolvidos através da combinação de deposição de camada atômica (ALD) de óxido de alumínio em um substrato adequado (por exemplo, FTO) e subsequente síntese de microondas solvotérmica. A camada de óxido de alumínio serve como um agente de direção da arquitetura e como uma fonte de metal para a espinha dorsal da estrutura MOF. A construção da estrutura metálica-orgânica porosa 3D ocorre durante a síntese de microondas, quando o substrato depositado na camada atômica é exposto a uma solução do ligante necessário em uma mistura DMF / H 2 O 3: 1 (v / v) em níveis elevados temperatura. Análogo, Kornienko e colaboradores descreveram em 2015 a síntese de uma porfirina de cobalto MOF (Al 2 (OH) 2 TCPP-Co; TCPP-H 2 = 4,4 ′, 4 ″, 4 ‴ - (porfirina-5,10, 15,20-tetrayl) tetrabenzoate), o primeiro catalisador MOF construído para a conversão de electrocatal�ico aquosa de CO 2 a CO .
Modificação pós-sintética
Embora a estrutura tridimensional e o ambiente interno dos poros possam, em teoria, ser controlados por meio da seleção adequada de nós e grupos de ligação orgânica, a síntese direta de tais materiais com as funcionalidades desejadas pode ser difícil devido à alta sensibilidade dos sistemas MOF. A sensibilidade térmica e química, bem como a alta reatividade dos materiais de reação, pode tornar a formação dos produtos desejados um desafio de se alcançar. A troca de moléculas hóspedes e contra-íons e a remoção de solventes permitem algumas funcionalidades adicionais, mas ainda estão limitados às partes integrantes da estrutura. A troca pós-sintética de ligantes orgânicos e íons metálicos é uma área em expansão do campo e abre possibilidades para estruturas mais complexas, funcionalidade aumentada e maior controle do sistema.
Troca de ligando
As técnicas de modificação pós-sintética podem ser usadas para trocar um grupo de ligação orgânico existente em um MOF pré-fabricado com um novo ligante por troca de ligante ou troca parcial de ligante. Essa troca permite que os poros e, em alguns casos, a estrutura geral dos MOFs sejam ajustados para fins específicos. Alguns desses usos incluem o ajuste fino do material para adsorção seletiva, armazenamento de gás e catálise. Para realizar a troca de ligante, os cristais MOF pré-fabricados são lavados com solvente e, em seguida, embebidos em uma solução do novo ligante. A troca geralmente requer calor e ocorre na escala de alguns dias. A troca de ligante pós-sintético também permite a incorporação de grupos funcionais em MOFs que, de outra forma, não sobreviveriam à síntese de MOF, devido à temperatura, pH ou outras condições de reação, ou impediriam a própria síntese por competição com grupos doadores no ligante emprestado.
Troca de metal
As técnicas de modificação pós-sintética também podem ser usadas para trocar um íon metálico existente em um MOF pré-fabricado por um novo íon metálico por troca iônica metálica. A metátese metálica completa de uma parte integrante da estrutura foi alcançada sem alterar a estrutura ou a estrutura dos poros do MOF. De maneira semelhante à troca de ligante pós-sintética, a troca de metal pós-sintética é realizada lavando cristais MOF pré-fabricados com solvente e, em seguida, mergulhando o cristal em uma solução do novo metal. A troca de metal pós-sintético permite uma rota simples para a formação de MOFs com a mesma estrutura, mas com íons metálicos diferentes.
Síntese estratificada
Além de modificar a funcionalidade dos próprios ligantes e metais, a modificação pós-sintética pode ser usada para expandir a estrutura do MOF. O uso de MOFs de modificação pós-sintética pode ser convertido de um material cristalino altamente ordenado em um material poroso heterogêneo. Usando técnicas pós-sintéticas, é possível a instalação controlada de domínios dentro de um cristal MOF que exibem características estruturais e funcionais únicas. MOFs core-shell e outros MOFs em camadas foram preparados onde as camadas têm funcionalização exclusiva, mas na maioria dos casos são cristalograficamente compatíveis de camada para camada.
Sites de coordenação abertos
Em alguns casos, o nó de metal MOF possui um ambiente não saturado e é possível modificar esse ambiente usando diferentes técnicas. Se o tamanho do ligante corresponder ao tamanho da abertura do poro, é possível instalar ligantes adicionais na estrutura MOF existente. Às vezes, os nós de metal têm uma boa afinidade de ligação para espécies inorgânicas. Por exemplo, foi mostrado que o nó de metal pode realizar uma extensão e criar uma ligação com o cátion uranila.
Materiais compostos
Outra abordagem para aumentar a adsorção em MOFs é alterar o sistema de tal forma que a quimissorção se torne possível. Esta funcionalidade foi introduzida pela fabricação de um material composto, que contém um MOF e um complexo de platina com carvão ativado . Em um efeito conhecido como transbordamento de hidrogênio , o H 2 pode se ligar à superfície da platina por meio de um mecanismo dissociativo que cliva a molécula de hidrogênio em dois átomos de hidrogênio e permite que eles viajem pelo carvão ativado até a superfície do MOF. Essa inovação produziu um aumento de três vezes na capacidade de armazenamento em temperatura ambiente de um MOF; no entanto, a dessorção pode levar mais de 12 horas, e a dessorção reversível às vezes é observada por apenas dois ciclos. A relação entre o transbordamento de hidrogênio e as propriedades de armazenamento de hidrogênio em MOFs não é bem compreendida, mas pode ser relevante para o armazenamento de hidrogênio.
Catálise
MOFs têm potencial como catalisadores heterogêneos , embora aplicações não tenham sido comercializadas. Sua alta área de superfície, porosidade ajustável, diversidade em grupos de metais e funcionais os tornam especialmente atraentes para uso como catalisadores. Os zeólitos são extraordinariamente úteis na catálise. Os zeólitos são limitados pela coordenação tetraédrica fixa dos pontos de conexão Si / Al e os ligantes de óxido de duas coordenadas. Menos de 200 zeólitos são conhecidos. Em contraste com este escopo limitado, os MOFs exibem geometrias de coordenação mais diversas , ligantes politópicos e ligantes auxiliares (F - , OH - , H 2 O, entre outros). Também é difícil obter zeólitas com tamanhos de poros maiores que 1 nm, o que limita as aplicações catalíticas de zeólitas a moléculas orgânicas relativamente pequenas (normalmente não maiores que xilenos ). Além disso, as condições sintéticas moderadas normalmente empregadas para a síntese de MOF permitem a incorporação direta de funcionalidades delicadas nas estruturas estruturais. Tal processo não seria possível com zeólitos ou outros materiais à base de óxido cristalino microporoso por causa das condições adversas tipicamente usadas para sua síntese (por exemplo, calcinação em altas temperaturas para remover moldes orgânicos). Metal-Organic Framework MIL-101 é um dos MOFs mais usados para catálise incorporando diferentes metais de transição, como o Cr. No entanto, a estabilidade de alguns fotocatalisadores MOF em meio aquoso e sob condições fortemente oxidantes é muito baixa.
Os zeólitos ainda não podem ser obtidos na forma enantiopura, o que impede suas aplicações em síntese assimétrica catalítica , por exemplo, para as indústrias farmacêutica, agroquímica e de fragrâncias. Ligantes quirais enantiopuros ou seus complexos de metal foram incorporados em MOFs para levar a catalisadores assimétricos eficientes. Mesmo alguns materiais MOF podem preencher a lacuna entre zeólitas e enzimas quando combinam sítios polinucleares isolados, respostas dinâmicas de hospedeiro-hóspede e um ambiente de cavidade hidrofóbica . MOFs podem ser úteis para fazer semicondutores. Cálculos teóricos mostram que os MOFs são semicondutores ou isolantes com band gaps entre 1,0 e 5,5 eV que podem ser alterados pela mudança do grau de conjugação nos ligantes indicando sua possibilidade de serem fotocatalisadores.
Projeto
Como outros catalisadores heterogêneos , os MOFs podem permitir uma separação e reciclabilidade pós-reação mais fácil do que os catalisadores homogêneos . Em alguns casos, eles também fornecem uma estabilidade do catalisador altamente aprimorada. Além disso, eles normalmente oferecem seletividade de tamanho de substrato. No entanto, embora seja claramente importante para as reações em sistemas vivos, a seletividade com base no tamanho do substrato é de valor limitado na catálise abiótica, uma vez que matérias-primas razoavelmente puras estão geralmente disponíveis.
Íons de metal ou aglomerados de metal
Entre os primeiros relatos de catálise baseada em MOF estava a cianossililação de aldeídos por um MOF 2D (grades quadradas em camadas) de fórmula Cd (4,4'-bpy) 2 (NO 3 ) 2 . Esta investigação centrou-se principalmente na clatração seletiva de tamanho e forma. Um segundo conjunto de exemplos foi baseado em um MOF de grade quadrada bidimensional contendo íons Pd (II) únicos como nós e 2-hidroxipirimidinolatos como suportes. Apesar da saturação coordenativa inicial , os centros de paládio neste MOF catalisam a oxidação do álcool, a hidrogenação da olefina e o acoplamento Suzuki C – C. No mínimo, essas reações implicam necessariamente oscilações redox dos nós de metal entre os intermediários Pd (II) e Pd (0), acompanhadas por mudanças drásticas no número de coordenação, o que certamente levaria à desestabilização e potencial destruição da estrutura original se todo o Pd centros são cataliticamente ativos. A observação da seletividade de formato e tamanho do substrato implica que as reações catalíticas são heterogêneas e estão de fato ocorrendo dentro do MOF. No entanto, pelo menos para a hidrogenação, é difícil descartar a possibilidade de que a catálise esteja ocorrendo na superfície de aglomerados / nanopartículas de paládio encapsuladas por MOF (ou seja, locais de decomposição parcial) ou locais de defeito, em vez de transitoriamente lábil, mas intacta. , nós MOF de átomo único. A catálise "oportunística" baseada em MOF foi descrita para o composto cúbico, MOF-5. Este material compreende nós de Zn 4 O saturados coordenativamente e um struts BDC totalmente complexado (ver abreviatura acima); ainda assim, aparentemente catalisa a terc-butilação de Friedel-Crafts do tolueno e do bifenil . Além disso, a paraalquilação é fortemente favorecida em relação à ortoalquilação, um comportamento que se pensa refletir o encapsulamento de reagentes pelo MOF.
Suportes funcionais
O material de estrutura porosa [Cu 3 (btc) 2 (H 2 O) 3 ] , também conhecido como HKUST-1, contém grandes cavidades com janelas de diâmetro ~ 6 Å. As moléculas de água coordenadas são facilmente removidas, deixando os locais de Cu (II) abertos. Kaskel e colaboradores mostraram que esses locais de ácido de Lewis podem catalisar a cianossililação de benzaldeído ou acetona . A versão anidra do HKUST-1 é um catalisador ácido. Em comparação com as vias catalisadas por ácido de Brønsted vs. Lewis , a seletividade do produto é distinta para três reações: isomerização de óxido de a-pineno, ciclização de citronelal e rearranjo de a-bromoacetais, indicando que de fato [Cu 3 (btc) 2 ] funciona principalmente como um catalisador ácido de Lewis . A seletividade do produto e o rendimento das reações catalíticas (por exemplo, ciclopropanação ) também mostraram ser impactados por locais defeituosos, como Cu (I) ou porções de ácido carboxílico incompletamente desprotonadas dos ligantes.
MIL-101, um MOF de grande cavidade com a fórmula [Cr 3 F (H 2 O) 2 O (BDC) 3 ], é um catalisador de cianossililação. As moléculas de água coordenadas no MIL-101 são facilmente removidas para expor os locais de Cr (III). Como se poderia esperar, dada a maior acidez de Lewis de Cr (III) vs. Cu (II), MIL-101 é muito mais ativo do que HKUST-1 como um catalisador para a cianossililação de aldeídos . Além disso, o grupo de Kaskel observou que os sítios catalíticos do MIL-101, em contraste com os do HKUST-1, são imunes à redução indesejada pelo benzaldeído . A cianossililação catalisada por ácido de Lewis de aldeídos aromáticos também foi realizada por Long e colaboradores usando um MOF da fórmula Mn 3 [(Mn 4 Cl) 3 BTT 8 (CH 3 OH) 10 ]. Este material contém uma estrutura de poro tridimensional, com o diâmetro do poro igual a 10 Å. Em princípio, qualquer um dos dois tipos de sítios Mn (II) poderia funcionar como um catalisador . As características notáveis deste catalisador são altos rendimentos de conversão (para substratos pequenos) e boa seletividade de tamanho de substrato, consistente com catálise canalizada.
Catalisadores encapsulados
A abordagem de encapsulamento MOF convida à comparação com estudos anteriores de catálise oxidativa por Fe encapsulado em zeólita ( porfirina ), bem como sistemas de Mn ( porfirina ). Os estudos de zeólita geralmente empregam iodosilbenzeno (PhIO), em vez de TPHP como oxidante. A diferença é provavelmente mecanicamente significativa, complicando as comparações. Resumidamente, PhIO é um único doador de átomo de oxigênio, enquanto TBHP é capaz de um comportamento mais complexo. Além disso, para o sistema baseado em MOF, é concebível que a oxidação prossiga através da transferência de oxigênio de um intermediário oxo de manganês , bem como de uma via de reação em cadeia radical iniciada por manganês . Independentemente do mecanismo, a abordagem é promissora para isolar e, assim, estabilizar as porfirinas contra a formação de dímero em ponte oxo e degradação oxidativa.
Modificadores de cavidade orgânica sem metal
A maioria dos exemplos de catálise baseada em MOF faz uso de íons ou átomos de metal como sítios ativos. Entre as poucas exceções estão dois MOFs contendo níquel - e dois cobre - sintetizados por Rosseinsky e colaboradores. Esses compostos empregam aminoácidos (L- ou D- aspartato ) junto com dipiridilas como struts. A química de coordenação é tal que o grupo amina do aspartato não pode ser protonado por HCl adicionado , mas um dos carboxilatos de aspartato pode. Assim, o aminoácido incorporado na estrutura pode existir em uma forma que não é acessível para o aminoácido livre . Enquanto os compostos à base de níquel são marginalmente porosos , devido às pequenas dimensões do canal, as versões de cobre são claramente porosas . O grupo Rosseinsky mostrou que os ácidos carboxílicos se comportam como catalisadores ácidos de Brønsted, facilitando (nos casos de cobre) a metanólise de abertura do anel de um epóxido pequeno, acessível por cavidade, com rendimento de até 65%. No entanto, existem catalisadores homogêneos superiores. Kitagawa e colaboradores relataram a síntese de um MOF catalítico com a fórmula [Cd (4-BTAPA) 2 (NO 3 ) 2 ]. O MOF é tridimensional, consistindo em um par idêntico de redes catenadas, mas ainda apresentando poros de dimensões moleculares. Os nós consistem em íons de cádmio únicos , ligados octaedricamente por nitrogênios de piridila. Do ponto de vista da catálise , no entanto, a característica mais interessante deste material é a presença de funcionalidades amida acessíveis ao hóspede . As amidas são capazes de catalisar por base a condensação de Knoevenagel de benzaldeído com malononitrila . As reações com nitrilos maiores , entretanto, são apenas marginalmente aceleradas, implicando que a catálise ocorre principalmente dentro dos canais do material, e não em seu exterior. Um achado digno de nota é a falta de catálise pela haste livre em solução homogênea, evidentemente devido à ligação H intermolecular entre as moléculas bptda. Assim, a arquitetura MOF induz atividade catalítica não encontrada de outra forma. Em uma abordagem alternativa interessante, Férey e colegas de trabalho foram capazes de modificar o interior do MIL-101 por meio da coordenação de Cr (III) de um dos dois átomos de nitrogênio disponíveis de cada uma das várias moléculas de etilenodiamina . As extremidades não coordenadas livres das etilenodiaminas foram então usadas como catalisadores básicos de Brønsted, novamente para a condensação Knoevenagel de benzaldeído com nitrilos . Uma terceira abordagem foi descrita por Kim Kimoon e colegas de trabalho. Usando um derivado do ácido tartárico funcionalizado com piridina e uma fonte de Zn (II), eles foram capazes de sintetizar um MOF 2D denominado POST-1. O POST-1 possui canais 1D cujas seções transversais são definidas por seis aglomerados trinucleares de zinco e seis escoras. Enquanto três das seis piridinas são coordenadas por íons de zinco , as três restantes são protonadas e direcionadas para o interior do canal. Quando neutralizados, os grupos piridil não coordenados são encontrados para catalisar reações de transesterificação , presumivelmente facilitando a desprotonação do álcool reagente . A ausência de catálise significativa quando grandes álcoois são empregados sugere fortemente que a catálise ocorre dentro dos canais do MOF.
Catálise aquiral
Metais como sítios catalíticos
Os metais na estrutura do MOF geralmente agem como ácidos de Lewis . Os metais nos MOFs geralmente se coordenam com moléculas de solventes lábeis ou contra-íons que podem ser removidos após a ativação da estrutura. A natureza ácida de Lewis de tais centros de metal insaturados pode ativar os substratos orgânicos coordenados para as transformações orgânicas subsequentes. O uso de centros de metal insaturado foi demonstrado na cianossililação de aldeídos e iminas por Fujita e colaboradores em 2004. Eles relataram MOF de composição {[Cd (4,4′-bpy) 2 (H 2 O) 2 ] • (NO 3 ) 2 • 4H 2 O} que foi obtido tratando o ligante de ponte linear 4,4′- bipiridina (bpy) com Cd (NO
3)
2. Os centros Cd (II) neste MOF possuem uma geometria octaédrica distorcida com quatro piridinas nas posições equatoriais e duas moléculas de água nas posições axiais para formar uma rede infinita bidimensional. Na ativação, duas moléculas de água foram removidas deixando os centros metálicos insaturados e ácidos de Lewis. O caráter ácido de Lewis do centro de metal foi testado em reações de cianossililação de imina, onde a imina fica ligada ao centro de metal ácido de Lewis, resultando em maior eletrofilia de iminas. Para a cianossililação de iminas, a maioria das reações foi concluída em 1 h, proporcionando aminonitrilas em rendimento quantitativo. Kaskel e colaboradores realizaram reações de cianossililação semelhantes com metais insaturados coordenativamente em MOFs tridimensionais (3D) como catalisadores heterogêneos. A estrutura 3D [Cu 3 (btc) 2 (H 2 O) 3 ] (btc: Benzeno-1,3,5-tricarboxilato) ( HKUST-1 ) usada neste estudo foi relatada pela primeira vez por Williams et al. A estrutura aberta de [Cu 3 (btc) 2 (H 2 O) 3 ] é construída a partir de unidades diméricas de tetracarboxilato cúprico (rodas de pás) com moléculas aqua que se coordenam às posições axiais e ligantes de ponte btc. A estrutura resultante após a remoção de duas moléculas de água das posições axiais possui um canal poroso. Este MOF ativado catalisa a trimetilcianosililação de benzaldeídos com uma conversão muito baixa (<5% em 24 h) a 293 K. Como a temperatura da reação foi elevada para 313 K, uma boa conversão de 57% com uma seletividade de 89% foi obtida após 72 h. Em comparação, foi observada conversão inferior a 10% para a reação de fundo (sem MOF) nas mesmas condições. Mas esta estratégia sofre de alguns problemas como 1) a decomposição da estrutura com aumento da temperatura de reação devido à redução de Cu (II) a Cu (I) pelos aldeídos ; 2) forte efeito de inibição do solvente; os solventes doadores de elétrons, como o THF, competiam com os aldeídos pela coordenação com os locais de Cu (II), e nenhum produto de cianossililação foi observado nesses solventes; 3) a instabilidade da estrutura em alguns solventes orgânicos. Vários outros grupos também relataram o uso de centros de metal em MOFs como catalisadores. Novamente, a natureza deficiente de elétrons de alguns metais e aglomerados de metal torna os MOFs catalisadores de oxidação eficientes . Mori e colaboradores relataram MOFs com unidades de roda de pás de Cu 2 como catalisadores heterogêneos para a oxidação de álcoois . A atividade catalítica do MOF resultante foi examinada realizando a oxidação do álcool com H 2 O 2 como oxidante. Também catalisou a oxidação de álcool primário, álcool secundário e álcoois benzílicos com alta seletividade. Hill et al. demonstraram a sulfoxidação de tioéteres usando um MOF baseado em unidades de construção vanádio-oxo cluster V 6 O 13 .
Ligantes funcionais como sítios catalíticos
Os ligantes funcionais também podem ser utilizados como sítios catalíticos. A 3D MOF {[Cd (4- BTAPA) 2 (NO 3 ) 2 ] • 6H 2 O • 2DMF} (4-BTAPA = 1,3,5-benzeno tricarboxílico tris [N- (4-piridil) amida] , DMF = N, N-dimetilformamida) construída por ligantes amida tridentada e sal de cádmio catalisa a reação de condensação de Knoevenagel . Os grupos piridina no ligante 4-BTAPA atuam como ligantes que se ligam aos centros octaédricos de cádmio, enquanto os grupos amida podem fornecer a funcionalidade para interação com os substratos de entrada. Especificamente, a porção -NH do grupo amida pode atuar como aceitador de elétrons, enquanto o grupo C = O pode atuar como doador de elétrons para ativar substratos orgânicos para reações subsequentes. Ferey et al. relataram um MOF robusto e altamente poroso [Cr 3 (µ 3 -O) F (H 2 O) 2 (BDC) 3 ] (BDC: Benzeno-1,4-dicarboxilato) onde em vez de usar diretamente o Cr (III) insaturado centros como sítios catalíticos, os autores enxertaram etilenodiamina (ED) nos sítios Cr (III). As extremidades descoordenadas de ED podem atuar como sítios catalíticos de base, MOF enxertado com ED foi investigado para reações de condensação de Knoevenagel. Um aumento significativo na conversão foi observado para MOF enxertado com ED em comparação com a estrutura não tratada (98% vs 36%). Outro exemplo de modificação de ligante para gerar sítio catalítico são MOFs baseados em Al bem conhecidos funcionalizados com iodo (MIL-53 e DUT-5) e MOFs baseados em Zr (UiO-66 e UiO-67) para a oxidação catalítica de dióis.
Apreensão de nanopartículas de metal nobre cataliticamente ativas
O aprisionamento de metais nobres cataliticamente ativos pode ser realizado por enxerto em grupos funcionais para o sítio de metal insaturado em MOFs. Foi demonstrado que a etilenodiamina (ED) é enxertada nos sítios de metal Cr e pode ser posteriormente modificada para encapsular metais nobres como o Pd. O Pd aprisionado tem atividade catalítica semelhante ao Pd / C na reação de Heck . Nanopartículas de rutênio têm atividade catalítica em várias reações quando aprisionadas na estrutura MOF-5. Este MOF encapsulado em Ru catalisa a oxidação do álcool benzílico em benzaldeído, embora ocorra degradação do MOF. O mesmo catalisador foi usado na hidrogenação do benzeno a ciclohexano . Em outro exemplo, nanopartículas de Pd incorporadas na estrutura HKUST-1 defeituosa permitem a geração de sites básicos de Lewis ajustáveis. Portanto, este composto multifuncional de Pd / MOF é capaz de realizar a oxidação do álcool benzílico e a condensação de Knoevenagel em etapas.
Hosts de reação com seletividade de tamanho
MOFs podem ser úteis para reações fotoquímicas e de polimerização devido à capacidade de ajuste do tamanho e formato de seus poros. Um 3D MOF {[Co (bpdc) 3 (bpy)] • 4DMF • H 2 O} (bpdc: bifenildicarboxilato, bpy: 4,4′-bipiridina) foi sintetizado por Li e colaboradores. Usando esta fotoquímica MOF de o- metil dibenzil cetona ( o -MeDBK) foi extensivamente estudada. Descobriu-se que esta molécula possui uma variedade de propriedades de reação fotoquímica, incluindo a produção de ciclopentanol . MOFs têm sido usados para estudar a polimerização no espaço confinado de canais MOF. As reações de polimerização em espaço confinado podem ter propriedades diferentes das da polimerização em espaço aberto. Estireno , divinilbenzeno , acetilenos substituídos , metacrilato de metila e acetato de vinila foram estudados por Kitagawa e colaboradores como possíveis monômeros ativados para polimerização radical . Devido ao tamanho do linker diferente, o tamanho do canal MOF pode ser ajustado na ordem de aproximadamente 25 e 100 Å 2 . Os canais mostraram estabilizar a propagação de radicais e suprimir reações de terminação quando usados como locais de polimerização de radical.
Catálise assimétrica
Existem várias estratégias para construir MOFs homoquirais . A cristalização de MOFs homoquirais por meio de autorresolução de ligantes ligantes aquirais é uma das maneiras de atingir esse objetivo. No entanto, as amostras coletivas resultantes contêm enantiomorfos e são racêmicas. Aoyama e colaboradores obtiveram com sucesso MOFs homoquirais em massa de ligantes aquirais controlando cuidadosamente a nucleação no processo de crescimento do cristal . Zheng e colaboradores relataram a síntese de MOFs homoquirais a partir de ligantes aquirais por meio da manipulação química da flutuação estatística da formação de pares enantioméricos de cristais. O cultivo de cristais MOF sob influências quirais é outra abordagem para obter MOFs homoquirais usando ligantes ligantes aquirais. Rosseinsky e seus colegas de trabalho introduziram um coligante quiral para direcionar a formação de MOFs homoquirais, controlando a lateralidade das hélices durante o crescimento do cristal. Morris e colaboradores utilizaram líquido iônico com cátions quirais como meio de reação para sintetizar MOFs e obtiveram MOFs homoquirais. A estratégia mais direta e racional para sintetizar MOFs homoquirais é, no entanto, usar os ligantes de ligação quirais prontamente disponíveis para sua construção.
MOFs homoquirais com funcionalidades interessantes e canais acessíveis a reagentes
MOFs homoquirais foram feitos por Lin e colegas de trabalho usando 2,2′-bis (difenilfosfino) -1,1′-binaftil ( BINAP ), 1,1′-bi-2,2′-naftol ( BINOL ) como ligantes quirais . Esses ligantes podem coordenar-se com sítios de metal cataliticamente ativos para aumentar a enantiosseletividade . Uma variedade de grupos de ligação, como piridina , ácido fosfônico e ácido carboxílico podem ser introduzidos seletivamente nas posições 3,3 ', 4,4' e 6,6 'da porção 1,1'-binaftila. Além disso, ao alterar o comprimento dos ligantes de ligação, a porosidade e a estrutura de estrutura do MOF podem ser ajustadas seletivamente.
Pós-modificação de MOFs homoquirais
Lin e colaboradores mostraram que a pós-modificação de MOFs pode ser alcançada para produzir MOFs homoquirais enantiosseletivos para uso como catalisadores. O MOF homoquiral 3D resultante {[Cd 3 (L) 3 Cl 6 ] • 4DMF • 6MeOH • 3H 2 O} (L = (R) -6,6'-dicloro-2,2'-dihidroxil-1,1 ' -binaftil-bipiridina) sintetizado por Lin mostrou ter uma eficiência catalítica semelhante para a reação de adição de dietilzinco em comparação com o análogo homogêneo quando foi pré- tratado por Ti (O i Pr) 4 para gerar as espécies de Ti-BINOLato enxertadas. A atividade catalítica dos MOFs pode variar dependendo da estrutura do framework. Lin e outros descobriram que os MOFs sintetizados a partir dos mesmos materiais podem ter atividades catalíticas drasticamente diferentes, dependendo da estrutura da estrutura presente.
MOFs homoquirais com pré-catalisadores como blocos de construção
Outra abordagem para construir MOFs homoquirais cataliticamente ativos é incorporar complexos de metais quirais que são catalisadores ativos ou pré-catalisadores diretamente nas estruturas estruturais. Por exemplo, Hupp e colegas de trabalho combinaram um ligante quiral e bpdc (bpdc: bifenildicarboxilato) com Zn (NO
3)
2e obteve redes 3D duplamente interpenetrantes. A orientação do ligante quiral nas estruturas torna todos os locais Mn (III) acessíveis através dos canais. As estruturas abertas resultantes mostraram atividade catalítica para reações de epoxidação de olefinas assimétricas. Nenhuma diminuição significativa da atividade do catalisador foi observada durante a reação e o catalisador pode ser reciclado e reutilizado várias vezes. Lin e colaboradores relataram sistemas Ru-BINAP derivados de fosfonato de zircônio. Materiais híbridos porosos quirais à base de fosfonato de zircônio contendo os pré-catalisadores Ru (BINAP) (diamina) Cl 2 mostraram excelente enantiosseletividade (até 99,2% ee) na hidrogenação assimétrica de cetonas aromáticas.
Desenho biomimético e fotocatálise
Alguns materiais MOF podem se assemelhar a enzimas quando combinam sítios polinucleares isolados, respostas dinâmicas de hospedeiro-hóspede e ambiente de cavidade hidrofóbica , que são características de uma enzima . Alguns exemplos bem conhecidos de catálise cooperativa envolvendo dois íons metálicos em sistemas biológicos incluem: os locais diiron na metano monooxigenase , dicobre na citocromo c oxidase e tricobre oxidases que têm analogia com aglomerados polinucleares encontrados nos polímeros de coordenação 0D, como Cu binuclear 2 unidades de roda de pás encontradas em MOP-1 e [Cu 3 (btc) 2 ] (btc = benzeno-1,3,5-tricarboxilato) em HKUST-1 ou unidades trinucleares como { Fe
3O (CO
2)
6} em MIL-88 e IRMOP-51. Assim, 0D MOFs têm centros catalíticos biomiméticos acessíveis . Em sistemas enzimáticos, as unidades de proteína apresentam "reconhecimento molecular", alta afinidade por substratos específicos. Parece que os efeitos do reconhecimento molecular são limitados nas zeólitas pela estrutura rígida da zeólita. Em contraste, os recursos dinâmicos e a resposta em forma de convidado tornam os MOFs mais semelhantes às enzimas. Na verdade, muitas estruturas híbridas contêm partes orgânicas que podem girar como resultado de estímulos, como luz e calor. Os canais porosos em estruturas MOF podem ser usados como locais de fotocatálise . Na fotocatálise, o uso de complexos mononucleares costuma ser limitado, seja porque eles passam por um processo de elétron único ou pela necessidade de irradiação de alta energia. Nesse caso, os sistemas binucleares apresentam uma série de características atrativas para o desenvolvimento de fotocatalisadores. Para estruturas 0D MOF, os nós policatiônicos podem atuar como pontos quânticos semicondutores que podem ser ativados mediante estímulos de foto com os ligantes servindo como antenas de fótons. Cálculos teóricos mostram que os MOFs são semicondutores ou isolantes com band gaps entre 1,0 e 5,5 eV que podem ser alterados pela mudança do grau de conjugação nos ligantes. Os resultados experimentais mostram que o gap de amostras do tipo IRMOF pode ser ajustado variando a funcionalidade do linker. Uma nanozima MOF integrada foi desenvolvida para terapia anti-inflamatória.
Formulários
Armazenamento de hidrogênio
O hidrogênio molecular tem a energia específica mais alta de qualquer combustível.
No entanto, a menos que o gás hidrogênio seja comprimido, sua densidade de energia volumétrica é muito baixa, de modo que o transporte e o armazenamento de hidrogênio exigem processos de compressão e liquefação com uso intensivo de energia. Portanto, o desenvolvimento de novos métodos de armazenamento de hidrogênio que diminuem a pressão concomitante necessária para a densidade de energia volumétrica prática é uma área ativa de pesquisa. Os MOFs atraem a atenção como materiais para armazenamento adsortivo de hidrogênio por causa de suas altas áreas de superfície específicas e relações entre superfície e volume, bem como suas estruturas quimicamente ajustáveis.
Comparado a um cilindro de gás vazio , um cilindro de gás cheio de MOF pode armazenar mais hidrogênio a uma determinada pressão porque as moléculas de hidrogênio são adsorvidas na superfície dos MOFs. Além disso, os MOFs não têm volume morto, portanto, quase não há perda de capacidade de armazenamento como resultado do bloqueio de espaço por volume não acessível. Além disso, como a captação de hidrogênio é baseada principalmente na fisiossorção , muitos MOFs têm um comportamento de captação e liberação totalmente reversível. Não são necessárias grandes barreiras de ativação ao liberar o hidrogênio adsorvido. A capacidade de armazenamento de um MOF é limitada pela densidade da fase líquida do hidrogênio porque os benefícios fornecidos pelos MOFs podem ser realizados apenas se o hidrogênio estiver em seu estado gasoso.
A extensão em que um gás pode ser adsorvido à superfície de um MOF depende da temperatura e da pressão do gás. Em geral, a adsorção aumenta com a diminuição da temperatura e o aumento da pressão (até que um máximo seja alcançado, normalmente 20-30 bar, após o qual a capacidade de adsorção diminui). No entanto, os MOFs a serem usados para armazenamento de hidrogênio em células de combustível automotivas precisam operar com eficiência em temperatura ambiente e pressões entre 1 e 100 bar, pois esses são os valores considerados seguros para aplicações automotivas.
O Departamento de Energia dos Estados Unidos (DOE) publicou uma lista de metas anuais do sistema técnico para armazenamento de hidrogênio a bordo para veículos leves com célula de combustível que orienta os pesquisadores no campo (5,5% em peso / 40 g L -1 até 2017; 7,5 % em peso / 70 g L -1 final). Materiais com alta porosidade e alta área de superfície, como MOFs, foram projetados e sintetizados em um esforço para atender a essas metas. Esses materiais adsortivos geralmente funcionam por meio de adsorção física, em vez de quimissorção, devido ao grande gap HOMO-LUMO e ao baixo nível de energia HOMO do hidrogênio molecular. Um material de referência para este fim é o MOF-177, que foi encontrado para armazenar hidrogênio a 7,5% em peso com uma capacidade volumétrica de 32 g L -1 a 77 K e 70 bar. MOF-177 consiste em clusters [Zn 4 O] 6+ interconectados por ligantes orgânicos 1,3,5-benzebetribenzoato e tem uma área de superfície BET medida de 4630 m 2 g -1 . Outro material exemplar é o PCN-61, que exibe uma absorção de hidrogênio de 6,24% em peso e 42,5 g L- 1 a 35 bar e 77 K e 2,25% em peso à pressão atmosférica. PCN-61 consiste em unidades de roda de pás [Cu 2 ] 4+ conectadas através de ligantes orgânicos 5,5 ′, 5 ′ ′ - benzeno-1,3,5-triyltris (1-etinil-2-isoftalato) e tem um Área de superfície BET de 3000 m 2 g -1 . Apesar desses exemplos de MOF promissores, as classes de materiais porosos sintéticos com o mais alto desempenho para armazenamento prático de hidrogênio são carvão ativado e estruturas orgânicas covalentes (COFs).
Princípios de design
As aplicações práticas de MOFs para armazenamento de hidrogênio enfrentam vários desafios. Para adsorção de hidrogênio perto da temperatura ambiente, a energia de ligação do hidrogênio precisaria ser aumentada consideravelmente. Várias classes de MOFs foram exploradas, incluindo MOFs à base de carboxilato , MOFs à base de azolato heterocíclico , MOFs de cianeto de metal e estruturas orgânicas covalentes . MOFs baseados em carboxilato têm recebido de longe a maior atenção porque
- eles estão disponíveis comercialmente ou são facilmente sintetizados,
- eles têm alta acidez (pK a ˜ 4) permitindo fácil desprotonação in situ ,
- a formação da ligação metal-carboxilato é reversível, facilitando a formação de MOFs cristalinos bem ordenados, e
- a capacidade de coordenação bidentada em ponte dos grupos carboxilato favorece o alto grau de conectividade da estrutura e fortes ligações metal-ligante necessárias para manter a arquitetura MOF sob as condições necessárias para evacuar o solvente dos poros.
Os metais de transição mais comuns empregados em estruturas à base de carboxilato são Cu 2+ e Zn 2+ . Íons de metal do grupo principal mais leves também foram explorados. Be 12 (OH) 12 (BTB) 4 , o primeiro MOF sintetizado e estruturalmente caracterizado com sucesso consistindo de um íon metálico do grupo principal leve, mostra alta capacidade de armazenamento de hidrogênio, mas é muito tóxico para ser empregado na prática. Há um esforço considerável sendo feito no desenvolvimento de MOFs compostos de outros íons metálicos do grupo principal leve, como magnésio em Mg 4 (BDC) 3 .
A seguir está uma lista de vários MOFs que são considerados como tendo as melhores propriedades para armazenamento de hidrogênio em maio de 2012 (em ordem decrescente de capacidade de armazenamento de hidrogênio). Embora cada MOF descrito tenha suas vantagens, nenhum desses MOFs atinge todos os padrões definidos pelo US DOE. Portanto, ainda não se sabe se os materiais com grandes áreas de superfície, poros pequenos ou aglomerados de metais di ou trivalentes produzem os MOFs mais favoráveis para o armazenamento de hidrogênio.
-
Zn 4 O (BTE) (BPDC) , onde BTE 3− = 4,4 ′, 4 ″ - [benzeno-1,3,5-triil-tris (etino-2,1-diil)] tribenzoato e BPDC 2− = bifenil-4,4′-dicarboxilato (MOF-210)
Capacidade de armazenamento de hidrogênio (a 77 K): 8,6% em peso em excesso (17,6% em peso total) a 77 K e 80 bar. 44 g total H 2 / L a 80 bar e 77 K.
Capacidade de armazenamento de hidrogênio (a 298 K): 2,90% em peso de entrega (1-100 bar) a 298 K e 100 bar. -
Zn 4 O (BBC) 2 , onde BBC 3− = 4,4 ′, 4 ″ - [benzeno-1,3,5-triil-tris (benzeno-4,1-diil)] tribenzoato (MOF-200)
Hidrogênio capacidade de armazenamento (a 77 K): 7,4% em peso em excesso (16,3% em peso total) a 77 K e 80 bar. 36 g total H 2 / L a 80 bar e 77 K.
capacidade de armazenamento de hidrogénio (a 298 K): 3,24 entrega% em peso (1-100 bar) a 298 K e 100 bar. -
Zn 4 O (BTB) 2 , onde BTB 3− = 1,3,5-benzenetribenzoato (MOF-177)
Estrutura: Unidades tetraédricas [Zn 4 O] 6+ são ligadas por grandes ligantes de tricarboxilato triangulares. Seis canais em forma de diamante (superior) com diâmetro de 10,8 Å circundam um poro contendo porções BTB 3− eclipsadas (inferior). Capacidade de armazenamento de hidrogênio: 7,1% em peso a 77 K e 40 bar; 11,4% em peso a 78 bar e 77 K. MOF-177 tem poros maiores, então o hidrogênio é comprimido dentro dos orifícios em vez de adsorvido na superfície. Isso leva a uma maior captação gravimétrica total, mas a uma densidade de armazenamento volumétrica menor em comparação com o MOF-5.
-
Zn 4 O (BDC) 3 , onde BDC 2− = 1,4-benzenodicarboxilato (MOF-5)
Estrutura: As aberturas quadradas são 13,8 ou 9,2 Å dependendo da orientação dos anéis aromáticos .
Capacidade de armazenamento de hidrogênio: 7,1% em peso a 77 K e 40 bar; 10% em peso a 100 bar; densidade volumétrica de armazenamento de 66 g / L.
O MOF-5 tem recebido muita atenção dos teóricos por causa das cargas parciais na superfície do MOF, que fornecem um meio de fortalecer o hidrogênio de ligação por meio de interações intermoleculares induzidas por dipolo ; no entanto, o MOF-5 tem baixo desempenho à temperatura ambiente (9,1 g / L a 100 bar). -
Mn 3 [(Mn 4 Cl) 3 (BTT) 8 ] 2 , onde H 3 BTT = benzeno-1,3,5-tris (1 H -tetrazol)
Estrutura: Consiste em gaiolas octaédricas truncadas que compartilham faces quadradas, levando a poros com cerca de 10 Å de diâmetro. Contém sites de coordenação Mn 2+ abertos .
Capacidade de armazenamento de hidrogênio: 60 g / L a 77 K e 90 bar; 12,1 g / L a 90 bar e 298 K. Este MOF é a primeira demonstração de locais abertos de coordenação de metal aumentando a força de adsorção de hidrogênio, o que resulta em desempenho aprimorado a 298 K. Possui interações metal-hidrogênio relativamente fortes, atribuídas a um spin mudança de estado na ligação ou para uma atração Coulombic clássica . -
Cu 3 (BTC) 2 (H 2 O) 3 , onde H 3 BTC = ácido 1,3,5-benzenotricarboxílico
Estrutura: Consiste em gaiolas octaédricas que compartilham unidades de roda de pás para definir poros de cerca de 9,8 Å de diâmetro.
A alta captação de hidrogênio é atribuída à sobreposição de potenciais atraentes de várias unidades de roda de pás de cobre: cada centro de Cu (II) pode perder um ligante de solvente terminal ligado na posição axial , fornecendo um local de coordenação aberto para a ligação de hidrogênio.
Impactos estruturais na capacidade de armazenamento de hidrogênio
Até o momento, o armazenamento de hidrogênio em MOFs à temperatura ambiente é uma batalha entre maximizar a capacidade de armazenamento e manter taxas de dessorção razoáveis, enquanto conserva a integridade da estrutura do adsorvente (por exemplo, evacua completamente os poros, preserva a estrutura do MOF, etc.) ao longo de muitos ciclos. Existem duas estratégias principais que regem o projeto de MOFs para armazenamento de hidrogênio:
- 1) para aumentar a capacidade teórica de armazenamento do material, e
- 2) aproximar as condições de operação da temperatura e pressão ambiente. Rowsell e Yaghi identificaram várias direções para esses fins em alguns dos primeiros artigos.
Superfície
A tendência geral em MOFs usados para armazenamento de hidrogênio é que quanto maior a área de superfície, mais hidrogênio o MOF pode armazenar. Materiais de alta área de superfície tendem a exibir volume de microporos aumentado e densidade aparente inerentemente baixa, permitindo que ocorra mais adsorção de hidrogênio.
Entalpia de adsorção de hidrogênio
A alta entalpia de adsorção de hidrogênio também é importante. Estudos teóricos mostraram que as interações de 22-25 kJ / mol são ideais para armazenamento de hidrogênio em temperatura ambiente, pois são fortes o suficiente para adsorver H 2 , mas fracas o suficiente para permitir uma rápida dessorção. A interação entre o hidrogênio e os ligantes orgânicos não carregados não é tão forte e, portanto, uma quantidade considerável de trabalho foi realizada na síntese de MOFs com sítios metálicos expostos, aos quais o hidrogênio é adsorvido com uma entalpia de 5-10 kJ / mol. Sinteticamente, isso pode ser alcançado usando ligantes cujas geometrias evitam que o metal seja totalmente coordenado, removendo moléculas de solvente ligadas ao metal volátil ao longo da síntese e por impregnação pós-sintética com cátions metálicos adicionais. (C
5H
5) V (CO)
3(H
2) e Mo (CO)
5(H
2) são ótimos exemplos de aumento da energia de ligação devido a locais abertos de coordenação de metal; entretanto, suas altas energias de dissociação da ligação metal-hidrogênio resultam em uma tremenda liberação de calor ao carregar o hidrogênio, o que não é favorável para células a combustível . MOFs, portanto, devem evitar interações orbitais que levam a tais ligações de hidrogênio-metal fortes e empregar interações dipolo induzidas por carga simples , como demonstrado em Mn 3 [(Mn 4 Cl) 3 (BTT) 8 ] 2 .
Uma energia de associação de 22-25 kJ / mol é típica de interações dipolo induzidas por carga e, portanto, há interesse no uso de ligantes e metais carregados. A força da ligação metal-hidrogênio é diminuída em MOFs, provavelmente devido à difusão de carga, então 2+ e 3+ íons metálicos estão sendo estudados para fortalecer essa interação ainda mais. Um problema com essa abordagem é que os MOFs com superfícies de metal expostas têm concentrações mais baixas de ligantes; isso os torna difíceis de sintetizar, pois estão sujeitos ao colapso da estrutura. Isso também pode diminuir sua vida útil.
Sensibilidade à umidade do ar
Os MOFs são freqüentemente sensíveis à umidade do ar. Em particular, IRMOF-1 degrada na presença de pequenas quantidades de água à temperatura ambiente. Estudos com análogos de metais revelaram a capacidade de outros metais, além do Zn, de suportar maiores concentrações de água em altas temperaturas.
Para compensar isso, são necessários contêineres de armazenamento especialmente construídos, o que pode ser caro. Ligações fortes de metal-ligante, como em estruturas de metal-imidazolato, -triazolato e -pirazolato, são conhecidas por diminuir a sensibilidade do MOF ao ar, reduzindo as despesas de armazenamento.
Tamanho de poro
Em um material microporoso onde a fisissorção e as forças fracas de van der Waals dominam a adsorção, a densidade de armazenamento depende muito do tamanho dos poros. Cálculos de materiais homogêneos idealizados, como carbonos grafíticos e nanotubos de carbono , prevêem que um material microporoso com poros de 7 Å exibirá absorção máxima de hidrogênio em temperatura ambiente. Nessa largura, exatamente duas camadas de moléculas de hidrogênio são adsorvidas em superfícies opostas, sem nenhum espaço entre elas. Os poros de 10 Å de largura também têm o tamanho ideal porque, com essa largura, exatamente três camadas de hidrogênio podem existir sem nenhum espaço entre elas. (Uma molécula de hidrogênio tem um comprimento de ligação de 0,74 Å com um raio de van der Waals de 1,17 Å para cada átomo; portanto, seu comprimento efetivo de van der Waals é 3,08 Å.)
Defeitos estruturais
Os defeitos estruturais também desempenham um papel importante no desempenho dos MOFs. A absorção de hidrogênio à temperatura ambiente por meio de transbordamento é governada principalmente por defeitos estruturais, que podem ter dois efeitos:
- 1) uma estrutura parcialmente colapsada pode bloquear o acesso aos poros; reduzindo assim a absorção de hidrogênio, e
- 2) defeitos de rede podem criar uma intrincada matriz de novos poros e canais, causando aumento da absorção de hidrogênio.
Defeitos estruturais também podem deixar nódulos contendo metal incompletamente coordenados. Isso melhora o desempenho dos MOFs usados para armazenamento de hidrogênio, aumentando o número de centros de metal acessíveis. Finalmente, defeitos estruturais podem afetar o transporte de fônons , o que afeta a condutividade térmica do MOF.
Adsorção de hidrogênio
Adsorção é o processo de aprisionar átomos ou moléculas que incidem em uma superfície; portanto, a capacidade de adsorção de um material aumenta com sua área de superfície. Em três dimensões, a área superficial máxima será obtida por uma estrutura altamente porosa, de forma que átomos e moléculas possam acessar as superfícies internas. Este argumento qualitativo simples sugere que as estruturas metal-orgânicas altamente porosas (MOFs) devem ser excelentes candidatas para dispositivos de armazenamento de hidrogênio.
A adsorção pode ser amplamente classificada como sendo um dos dois tipos: fisissorção ou quimissorção . A fisiossorção é caracterizada por fracas interações de van der Waals e entalpias de ligação tipicamente menores que 20 kJ / mol. A quimissorção, alternativamente, é definida por ligações covalentes e iônicas mais fortes , com entalpias de ligação entre 250 e 500 kJ / mol. Em ambos os casos, os átomos ou moléculas adsorvidos (ou seja, as partículas que aderem à superfície) são atraídos para a superfície do adsorvente (sólido) por causa da energia superficial que resulta de locais de ligação não ocupados na superfície. O grau de sobreposição orbital determina então se as interações serão fisiossortivas ou quimissortivas.
A adsorção de hidrogênio molecular em MOFs é fisiossortiva. Como o hidrogênio molecular tem apenas dois elétrons, as forças de dispersão são fracas, normalmente 4-7 kJ / mol, e são suficientes apenas para adsorção em temperaturas abaixo de 298 K.
Uma explicação completa do mecanismo de sorção de H 2 em MOFs foi obtida pela média estatística no grande conjunto canônico, explorando uma ampla gama de pressões e temperaturas.
Determinando a capacidade de armazenamento de hidrogênio
Dois métodos de medição de absorção de hidrogênio são usados para a caracterização de MOFs como materiais de armazenamento de hidrogênio: gravimétrico e volumétrico . Para obter a quantidade total de hidrogênio no MOF, tanto a quantidade de hidrogênio absorvido em sua superfície quanto a quantidade de hidrogênio residindo em seus poros devem ser consideradas. Para calcular a quantidade absoluta absorvida ( N abs ), a quantidade de excesso de superfície ( N ex ) é adicionada ao produto da densidade aparente do hidrogênio (ρ bulk ) e o volume do poro do MOF ( V poro ), como mostrado no seguinte equação:
Método gravimétrico
O aumento da massa do MOF devido ao hidrogênio armazenado é calculado diretamente por uma microbalança altamente sensível. Devido à flutuabilidade , a massa detectada de hidrogênio adsorvido diminui novamente quando uma pressão suficientemente alta é aplicada ao sistema, porque a densidade do hidrogênio gasoso circundante torna-se cada vez mais importante em pressões mais altas. Assim, essa "perda de peso" deve ser corrigida usando o volume da moldura do MOF e a densidade do hidrogênio.
Método volumétrico
A variação da quantidade de hidrogênio armazenado no MOF é medida pela detecção da pressão variada de hidrogênio em volume constante. O volume de hidrogênio adsorvido no MOF é então calculado subtraindo o volume de hidrogênio no espaço livre do volume total de hidrogênio dosado.
Outros métodos de armazenamento de hidrogênio
Existem seis métodos possíveis que podem ser usados para o armazenamento reversível de hidrogênio com uma alta densidade volumétrica e gravimétrica, que estão resumidos na tabela a seguir, (onde ρ m é a densidade gravimétrica, ρ v é a densidade volumétrica, T é a temperatura de trabalho, e P é a pressão de trabalho):
| Método de armazenamento | ρ m (massa%) | ρ v (kg H 2 / m 3 ) | T (° C) | P (bar) | Observações |
|---|---|---|---|---|---|
| Cilindros de gás de alta pressão | 13 | <40 | 25 | 800 | Gás H 2 comprimido em cilindro composto leve |
| Hidrogênio líquido em tanques criogênicos | dependente do tamanho | 70,8 | -252 | 1 | H líquido 2 ; perda contínua de alguns por cento de H 2 por dia a 25 ° C |
| Hidrogênio adsorvido | ~ 2 | 20 | -80 | 100 | Fiseorção de H 2 em materiais |
| Adsorvido em sites intersticiais em um metal hospedeiro | ~ 2 | 150 | 25 | 1 | Hidrogênio atômico adsorve reversivelmente em metais hospedeiros |
| Compostos complexos | <18 | 150 | > 100 | 1 | Compostos complexos ([AlH 4 ] - ou [BH 4 ] - ); dessorção em temperatura elevada, adsorção em altas pressões |
| Metal e complexos junto com água | <40 | > 150 | 25 | 1 | Oxidação química de metais com água e liberação de H 2 |
Destes, cilindros de gás de alta pressão e hidrogênio líquido em tanques criogênicos são as maneiras menos práticas de armazenar hidrogênio para fins de combustível devido à pressão extremamente alta necessária para armazenar gás hidrogênio ou à temperatura extremamente baixa necessária para armazenar hidrogênio líquido. Os outros métodos estão todos sendo estudados e desenvolvidos extensivamente.
Eletrocatálise
A alta área de superfície e os locais de metal atômico dos MOFs os tornam candidatos adequados para eletrocatalisadores , especialmente os relacionados à energia. Até agora, os MOFs têm sido usados extensivamente como eletrocatalisador para separação de água (reação de evolução de hidrogênio e reação de evolução de oxigênio), redução de dióxido de carbono e reação de redução de oxigênio. Atualmente, existem duas rotas: 1. Usando MOFs como precursores para preparar eletrocatalisadores com suporte de carbono. 2. Usando MOFs diretamente como eletrocatalisadores. No entanto, alguns resultados mostraram que alguns MOFs não são estáveis em ambiente eletroquímico. A conversão eletroquímica de MOFs durante a eletrocatálise pode produzir os materiais catalisadores reais, e os MOFs são pré-catalisadores sob tais condições. Portanto, reivindicar MOFs como eletrocatalisadores requer técnicas in situ acopladas à eletrocatálise.
Imagens e sensores biológicos
Uma aplicação potencial para MOFs é a geração de imagens biológicas e detecção por fotoluminescência. Um grande subconjunto de MOFs luminescentes usa lantanídeos nos aglomerados de metal. A fotoluminescência de lantanídeos tem muitas propriedades exclusivas que os tornam ideais para aplicações de imagem, como bandas de emissão caracteristicamente nítidas e geralmente não sobrepostas nas regiões visível e infravermelho próximo (NIR) do espectro, resistência a fotodegradação ou 'piscar' e longo vidas de luminescência. No entanto, as emissões de lantanídeos são difíceis de sensibilizar diretamente porque devem sofrer transições ff proibidas por LaPorte . A sensibilização indireta da emissão de lantanídeos pode ser realizada empregando o "efeito de antena", em que os ligantes orgânicos atuam como antenas e absorvem a energia de excitação, transferem a energia para o estado excitado do lantanídeo e geram luminescência de lantanídeo após o relaxamento. Um excelente exemplo do efeito da antena é demonstrado pelo MOF-76, que combina íons lantanídeos trivalentes e ligantes 1,3,5-benzenotricarboxilato (BTC) para formar SBUs de haste infinita coordenada em uma rede tridimensional. Conforme demonstrado por vários grupos de pesquisa, o ligante BTC pode efetivamente sensibilizar a emissão de lantanídeos, resultando em um MOF com comprimentos de onda de emissão variáveis, dependendo da identidade do lantanídeo. Além disso, o grupo Yan mostrou que Eu 3+ - e Tb 3+ - MOF-76 podem ser usados para a detecção seletiva de acetofenona de outros hidrocarbonetos monoaromáticos voláteis. Após a captação de acetofenona, o MOF mostra uma diminuição muito acentuada, ou extinção , da intensidade de luminescência.
Para uso em imagens biológicas, no entanto, dois obstáculos principais devem ser superados:
- MOFs devem ser sintetizados em nanoescala para não afetar as interações normais ou o comportamento do alvo
- Os comprimentos de onda de absorção e emissão devem ocorrer em regiões com sobreposição mínima da autofluorescência da amostra, outras espécies de absorção e penetração máxima no tecido.
Em relação ao primeiro ponto, a síntese de MOF em nanoescala (NMOF) foi mencionada em uma seção anterior. O último obstáculo aborda a limitação do efeito da antena. Ligantes menores tendem a melhorar a estabilidade do MOF, mas têm maior absorção de energia, predominantemente nas regiões ultravioleta (UV) e visível de alta energia. Uma estratégia de projeto para MOFs com propriedades de absorção redshifted foi realizada usando grandes ligantes cromóforos. Esses ligantes são frequentemente compostos de espécies poliaromáticas, levando a grandes tamanhos de poros e, portanto, estabilidade diminuída. Para contornar o uso de ligantes grandes, outros métodos são necessários para mudar para o vermelho a absorbância do MOF para que fontes de excitação de energia mais baixas possam ser usadas. A modificação pós-sintética (PSM) é uma estratégia promissora. Luo et al. introduziu uma nova família de MOFs de lantanídeos com ligantes orgânicos funcionalizados. Os MOFs, considerados MOF-1114, MOF-1115, MOF-1130 e MOF-1131, são compostos de SBUs octaédricos ligados por ligantes dicarboxilato funcionalizados com amino. Os grupos amino nos ligantes serviram como locais para reações covalentes de PSM com salicilaldeído ou 3-hidroxinaftaleno-2-carboxialdeído. Ambas as reações estendem a conjugação π do ligante, causando um desvio para o vermelho no comprimento de onda de absorbância de 450 nm para 650 nm. Os autores também propõem que esta técnica pode ser adaptada a sistemas MOF semelhantes e, ao aumentar os volumes dos poros com comprimentos de linker crescentes, reagentes conjugados pi maiores podem ser usados para desviar ainda mais para o vermelho os comprimentos de onda de absorção. A imagem biológica com MOFs foi realizada por vários grupos, nomeadamente Foucault-Collet e colaboradores. Em 2013, eles sintetizaram um Yb 3+ -NMOF emissor de NIR usando ligantes dicarboxilato de fenilenevinileno (PVDC). Eles foram observados captação celular em células HeLa e células NIH-3T3 usando espectroscopia confocal, visível e NIR. Embora os baixos rendimentos quânticos persistam na água e na solução tampão Hepes, a intensidade da luminescência ainda é forte o suficiente para a captação celular da imagem em ambos os regimes visível e NIR.
Materiais de resíduos nucleares
O desenvolvimento de novos caminhos para a administração eficiente de resíduos nucleares é essencial, devido ao aumento da preocupação pública com a contaminação radioativa, devido à operação da usina nuclear e ao desmantelamento de armas nucleares. A síntese de novos materiais capazes de sequestro e separação seletiva de actinídeos é um dos desafios atuais reconhecidos no setor de resíduos nucleares. Estruturas metal-orgânicas (MOFs) são uma classe promissora de materiais para enfrentar esse desafio devido à sua porosidade, modularidade, cristalinidade e sintonia. Podemos usar todos os blocos de construção da estrutura do MOF para incorporação de actinídeos. Primeiro, podemos sintetizar o MOF a partir de sais de actinídeo. Neste caso, os actinídeos vão para o nó de metal. Além disso, em termos de nós metálicos, podemos fazer a extensão dos nós metálicos ou podemos fazer a troca catiônica. Também podemos usar ligantes orgânicos e funcionalizá-lo com grupos capazes de absorção de actinídeos. E por último, mas não menos importante, podemos usar a porosidade dos MOFs para incorporar moléculas hóspedes contidas e prendê-las em uma estrutura por meio da instalação de ligantes adicionais ou de cobertura.
Sistemas de entrega de drogas
A síntese, caracterização e estudos relacionados a medicamentos de MOFs biocompatíveis e de baixa toxicidade mostraram que eles têm potencial para aplicações médicas. Muitos grupos sintetizaram vários MOFs de baixa toxicidade e estudaram seus usos no carregamento e liberação de vários medicamentos terapêuticos para potenciais aplicações médicas. Existe uma variedade de métodos para induzir a liberação de drogas, como resposta ao pH, resposta magnética, resposta iônica, resposta à temperatura e resposta à pressão.
Em 2010, Smaldone et al., Um grupo de pesquisa internacional, sintetizou um MOF biocompatível denominado CD-MOF-1 a partir de produtos naturais comestíveis baratos. O CD-MOF-1 consiste em unidades de base repetidas de 6 anéis de γ-ciclodextrina unidos por íons de potássio. A γ-ciclodextrina (γ-CD) é um oligossacarídeo cíclico simétrico que é produzido em massa enzimaticamente a partir do amido e consiste em oito resíduos D-glucopiranosil ligados a α-1,4 assimétricos. A estrutura molecular desses derivados de glicose, que se aproxima de um cone truncado, balde ou toro, gera uma superfície externa hidrofílica e uma cavidade interna apolar. As ciclodextrinas podem interagir com moléculas de drogas de tamanho apropriado para produzir um complexo de inclusão. O grupo de Smaldone propôs uma síntese simples e barata do CD-MOF-1 a partir de produtos naturais. Dissolveram açúcar (γ-ciclodextrina) e um sal alcalino (KOH, KCl, benzoato de potássio) em água destilada engarrafada e permitiram que o álcool de grãos 190 (Everclear) se difundisse na solução por uma semana. A síntese resultou em um motivo de repetição cúbico (γ-CD) 6 com um tamanho de poro de aproximadamente 1 nm. Posteriormente, em 2017, Hartlieb et al. na Northwestern fez pesquisas adicionais com CD-MOF-1 envolvendo o encapsulamento de ibuprofeno. O grupo estudou diferentes métodos de carregar o MOF com ibuprofeno, bem como realizar estudos de biodisponibilidade relacionados no MOF carregado com ibuprofeno. Eles investigaram dois métodos diferentes de carregar CD-MOF-1 com ibuprofeno; cristalização usando o sal de potássio de ibuprofeno como fonte de cátions alcalinos para a produção de MOF e absorção e desprotonação do ácido livre de ibuprofeno no MOF. A partir daí, o grupo realizou estudos in vitro e in vivo para determinar a aplicabilidade do CD-MOF-1 como um método de entrega viável para ibuprofeno e outros AINEs. Os estudos in vitro não mostraram toxicidade ou efeito na viabilidade celular até 100 μM. Estudos in vivo em camundongos mostraram a mesma rápida absorção de ibuprofeno que a amostra de controle de sal de potássio de ibuprofeno com uma concentração plasmática máxima observada em 20 minutos, e o cocristal tem o benefício adicional de dobrar a meia-vida em amostras de plasma sanguíneo. O aumento na meia-vida é devido ao CD-MOF-1 aumentar a solubilidade do ibuprofeno em comparação com a forma de sal puro.
Desde esses desenvolvimentos, muitos grupos fizeram pesquisas adicionais sobre a distribuição de medicamentos com MOFs biocompatíveis e solúveis em água envolvendo medicamentos comuns sem receita. Em março de 2018, Sara Rojas e sua equipe publicaram sua pesquisa sobre a incorporação e distribuição de medicamentos com vários MOFs biocompatíveis, além do CD-MOF-1, por meio de administração cutânea simulada. O grupo estudou o carregamento e a liberação de ibuprofeno (hidrofóbico) e aspirina (hidrofílico) em três MOFs biocompatíveis (MIL-100 (Fe), UiO-66 (Zr) e MIL-127 (Fe)). Sob condições cutâneas simuladas (meio aquoso a 37 ° C), as seis combinações diferentes de MOFs carregados com fármaco cumpriram "os requisitos para serem usados como sistemas de entrega de fármacos tópicos, como carga útil liberada entre 1 e 7 dias" e entrega de uma concentração terapêutica da droga de escolha sem causar efeitos colaterais indesejados. O grupo descobriu que a absorção da droga é "governada pelo equilíbrio hidrofílico / hidrofóbico entre carga e matriz" e "a acessibilidade da droga por meio da estrutura". A "liberação controlada sob condições cutâneas segue perfis cinéticos diferentes, dependendo: (i) da estrutura da estrutura, com uma entrega rápida da estrutura muito aberta MIL-100 ou uma liberação mais lenta da droga do estreito sistema de poros 1D de MIL- 127 ou (ii) a natureza hidrofóbica / hidrofílica da carga, com uma liberação rápida (Aspirina) e lenta (Ibuprofeno) da matriz UiO-66. "
Pesquisas recentes envolvendo MOFs como um método de entrega de medicamentos incluem mais do que apenas o encapsulamento de medicamentos de uso diário, como o ibuprofeno e a aspirina. No início de 2018, Chen et al., Publicou detalhando seu trabalho sobre o uso de MOF, ZIF-8 (zeolitic imidazolate framework-8) na pesquisa antitumoral "para controlar a liberação de um inibidor de autofagia, 3-metiladenina (3-MA), e evitar que ele se dissipe em grande quantidade antes de atingir o alvo. " O grupo realizou estudos in vitro e determinou que "as proteínas relacionadas à autofagia e o fluxo de autofagia em células HeLa tratadas com NPs 3-MA @ ZIF-8 mostram que a formação de autofagossomos está significativamente bloqueada, o que revela que a dissociação sensível ao pH aumenta o eficiência da inibição da autofagia na concentração equivalente de 3-MA. " Isso se mostra promissor para pesquisas futuras e aplicabilidade com MOFs como métodos de entrega de medicamentos na luta contra o câncer.
Semicondutores
Em 2014, os pesquisadores provaram que podem criar filmes finos eletricamente condutores de MOFs (Cu 3 (BTC) 2 (também conhecido como HKUST-1 ; BTC, ácido benzeno-1,3,5-tricarboxílico) infiltrados com a molécula 7,7, 8,8-tetracianoquinododimetano) que poderia ser usado em aplicações, incluindo fotovoltaicos, sensores e materiais eletrônicos e um caminho para a criação de semicondutores. A equipe demonstrou condutividade elétrica ajustável e estável ao ar com valores de até 7 siemens por metro, comparável ao bronze.
Ni
3(2,3,6,7,10,11-hexaiminotrifenileno) 2 mostrou ser um análogo metal-orgânico do grafeno que tem um gap natural , o que o torna um semicondutor, e é capaz de se automontar. É um exemplo de estrutura orgânica metálica condutiva . Ele representa uma família de compostos semelhantes. Por causa da simetria e geometria em 2,3,6,7,10,11-hexaiminotrifenileno (HITP), o complexo organometálico geral tem uma natureza quase fractal que permite que ele se auto-organize perfeitamente. Em contraste, o grafeno deve ser dopado para dar a ele as propriedades de um semicondutor. Pelotas de Ni 3 (HITP) 2 tinham uma condutividade de 2 S / cm, um recorde para um composto orgânico-metálico.
Em 2018, pesquisadores sintetizaram um MOF semicondutor bidimensional (Fe 3 (THT) 2 (NH 4 ) 3 , também conhecido como THT, 2,3,6,7,10,11-trifenilenohexatiol) e apresentou alta mobilidade elétrica em temperatura ambiente . Em 2020, o mesmo material foi integrado em um dispositivo de fotodetecção, detectando uma ampla faixa de comprimento de onda de UV a NIR (400–1575 nm). Esta foi a primeira vez que um MOF semicondutor bidimensional foi demonstrado para ser usado em dispositivos optoeletrônicos.
Mineralização bio-mimética
As biomoléculas podem ser incorporadas durante o processo de cristalização do MOF. Biomoléculas incluindo proteínas, DNA e anticorpos podem ser encapsuladas em ZIF-8. As enzimas encapsuladas desta forma eram estáveis e ativas mesmo após serem expostas a condições adversas (por exemplo, solventes agressivos e alta temperatura). ZIF-8, MIL-88A, HKUST-1 e vários MOFs luminescentes contendo metais lantanídeos foram usados para o processo de mineralização biomimética.
Captura de carbono
Por causa de seus pequenos tamanhos de poros ajustáveis e altas frações de vazio, os MOFs são um material potencial promissor para uso como um adsorvente para capturar CO 2 . Os MOFs podem fornecer uma alternativa mais eficiente aos métodos tradicionais baseados em solvente de amina na captura de CO 2 de usinas termelétricas a carvão.
Os MOFs podem ser empregados em cada uma das três principais configurações de captura de carbono para usinas termelétricas a carvão: pré-combustão, pós-combustão e oxicombustão. No entanto, como a configuração de pós-combustão é a única que pode ser adaptada às plantas existentes, ela atrai mais interesse e pesquisa. Na captura de carbono pós-combustão, o gás de combustão da usina seria alimentado por um MOF em uma configuração de reator de leito fixo. O gás de combustão é geralmente de 40 a 60 ° C com uma pressão parcial de CO 2 de 0,13 - 0,16 bar. O CO 2 pode se ligar à superfície MOF por meio de fisiossorção , que é causada por interações de Van der Waals , ou quimissorção , que é causada pela formação de ligações covalentes . Uma vez que o MOF está saturado com CO 2 , o CO 2 seria removido do MOF por meio de uma oscilação de temperatura ou de pressão. Este processo é conhecido como regeneração. Em uma regeneração por oscilação de temperatura, o MOF seria aquecido até que o CO 2 fosse dessorvido. Para atingir capacidades de trabalho comparáveis ao processo de amina, o MOF deve ser aquecido a cerca de 200 ° C. Em uma oscilação de pressão, a pressão seria diminuída até que o CO 2 fosse dessorvido.
Além de suas seletividades ajustáveis para moléculas diferentes, outra propriedade dos MOFs que os torna um bom candidato para a captura de carbono é sua baixa capacidade de calor. As soluções de monoetanolamina (MEA), o principal método para capturar CO 2 dos gases de combustão, têm uma capacidade de calor entre 3-4 J / g K, uma vez que são principalmente água. Essa alta capacidade de calor contribui para a penalidade de energia na etapa de regeneração do solvente, ou seja, quando o CO 2 adsorvido é removido da solução de MEA. MOF-177, um MOF projetado para captura de CO 2 , tem uma capacidade de calor de 0,5 J / g K à temperatura ambiente.
Em um projeto colaborativo patrocinado pelo US DOE, os MOFs mostraram separar 90% do CO 2 do fluxo de gás de combustão usando um processo de oscilação de pressão a vácuo. O MOF Mg (dobdc) tem um CO 21,7% em peso de 2 a capacidade de carregamento. As estimativas mostraram que, se um sistema semelhante fosse aplicado a uma usina de grande escala, o custo da energia aumentaria em 65%, enquanto um sistema baseado em amina da linha de base US NETL causaria um aumento de 81% (a meta do US DOE é 35%). O custo de captura de CO 2 seria de $ 57 / tonelada de CO 2 capturado, enquanto para o sistema de amina o custo é estimado em $ 72 / tonelada de CO 2 capturado. O projeto estimou que o capital total necessário para implementar tal projeto em uma usina de 580 MW seria de $ 354 milhões.
Dessalinização / separação de íons
As membranas MOF podem imitar a seletividade iônica substancial. Isso oferece potencial para uso em dessalinização e tratamento de água. Em 2018, a osmose reversa fornecia mais da metade da capacidade global de dessalinização e o último estágio da maioria dos processos de tratamento de água. A osmose não usa desidratação de íons, ou transporte seletivo de íons em canais biológicos e não é eficiente em termos de energia. A indústria de mineração usa processos baseados em membrana para reduzir a poluição da água e recuperar metais. Os MOFs podem ser usados para extrair metais como o lítio da água do mar e de fluxos de resíduos.
As membranas MOF, como as membranas ZIF-8 e UiO-66, com poros subnanômetros uniformes que consistem em janelas em escala angstrom e cavidades em escala nanométrica exibiram transporte seletivo ultrarrápido de íons de metais alcalinos. As janelas agiam como filtros de seletividade de íons para íons de metais alcalinos, enquanto as cavidades funcionavam como poros para transporte. As membranas ZIF-8 e UiO-66 mostraram uma seletividade LiCl / RbCl de ~ 4,6 e ~ 1,8, respectivamente, muito maior do que a seletividade de 0,6 a 0,8 em membranas tradicionais. Um estudo de 2020 sugeriu que um novo MOF chamado PSP-MIL-53 poderia ser usado junto com a luz do sol para purificar a água em apenas meia hora.
Separação de Gás
Também se prevê que os MOFs sejam meios muito eficazes para separar gases com baixo custo de energia, usando triagem computacional de alto rendimento de suas propriedades de adsorção ou penetração / difusão de gás. Um dos exemplos é o NbOFFIVE-1-Ni, também conhecido como KAUST-7, que pode separar o propano e o propileno por difusão com quase 100% de seletividade. As propriedades específicas de seletividade da molécula fornecidas pelo crescimento da estrutura orgânica de metal de superfície montada em Cu-BDC (SURMOF-2) na camada de alumina no topo do Transistor de Efeito de Campo de Grafeno (GFET) pode fornecer um sensor que é sensível apenas ao etanol, mas não ao metanol ou isopropanol.
Captura de vapor de água e desumidificação
Foi demonstrado que os MOFs capturam o vapor de água do ar. Em 2021, sob condições úmidas, um protótipo de laboratório de polímero-MOF rendeu 17 litros (4,5 gal) de água por kg por dia sem adição de energia.
Os MOFs também podem ser usados para aumentar a eficiência energética em aplicações de resfriamento em temperatura ambiente.
Quando arrefecimento do ar exterior, uma unidade de arrefecimento tem que lidar com tanto do ar calor sensível e calor latente . Unidades típicas de condicionamento de ar por compressão de vapor (VCAC) gerenciam o calor latente no ar por meio de aletas de resfriamento mantidas abaixo da temperatura do ponto de orvalho do ar úmido na entrada. Essas aletas condensam a água, desidratando o ar e reduzindo substancialmente o conteúdo de calor do ar. O uso de energia do resfriador é altamente dependente da temperatura da serpentina de resfriamento e seria melhorado muito se a temperatura desta serpentina pudesse ser elevada acima do ponto de orvalho . Isso torna desejável lidar com a desumidificação por outros meios que não a condensação. Um desses meios é adsorver a água do ar em um dessecante revestido nos trocadores de calor, usando o calor residual exaurido da unidade para dessorver a água do sorvente e, assim, regenerar o dessecante para uso repetido. Isso é conseguido por ter duas unidades condensador / evaporador através das quais o fluxo do refrigerante pode ser revertido uma vez que o dessecante no condensador esteja saturado, tornando o condensador o evaporador e vice-versa.
As áreas superficiais e porosidades extremamente altas dos MOFs os tornaram objeto de muitas pesquisas em aplicações de adsorção de água. A química pode ajudar a ajustar a umidade relativa ideal para adsorção / dessorção e a nitidez da captação de água.
Ferroelétricos e multiferróicos
Alguns MOFs também exibem polarização elétrica espontânea, que ocorre devido ao ordenamento de dipolos elétricos (ligantes polares ou moléculas hóspedes) abaixo de uma certa temperatura de transição de fase. Se essa ordem dipolar de longo alcance pode ser controlada pelo campo elétrico externo, um MOF é chamado de ferroelétrico. Alguns MOFs ferroelétricos também exibem ordenação magnética, tornando-os multiferróicos monofásicos. Esta propriedade do material é altamente interessante para a construção de dispositivos de memória com alta densidade de informação. O mecanismo de acoplamento do multiferroico molecular tipo I [(CH 3 ) 2 NH 2 ] [Ni (HCOO) 3 ] é o acoplamento indireto mediado por deformação elástica espontânea.
Veja também
- Estrutura orgânica covalente
- Teoria BET
- Polímero microporoso conjugado
- Química de coordenação
- Polímeros de coordenação
- Criogenia
- Eletrocatalisador
- Redes de cristal (gráficos periódicos)
- Hidrogênio
- Economia de hidrogênio
- Hidrogênio líquido
- Conjunto macromolecular
- Estrutura metal-inorgânica
- Omar M. Yaghi
- Susumu Kitagawa
- Gérard Férey
- Química Organometálica
- Departamento de Energia dos Estados Unidos
- Cristalografia de raio-x
- Estruturas de imidazolato zeolítico
- Sorventes sólidos para captura de carbono
- Estrutura flexível metal-orgânica
Referências
links externos
| Scholia tem um perfil para estrutura metal-orgânica (Q909212) . |